Memorial Hastanesi Tüp Bebek Merkezi Androloji Laboratuvarı gelişmiş teknik olanakları ve deneyimli biyologları ile semen örneğini en ayrıntılı şekilde inceleyip değerlendirecek, gerektiğinde kullanıma hazır hale getirecek donanıma sahiptir. İnceleme sonrası elde edilen bu bilgiler hastalarımızla da paylaşılarak onların da bilgilendirilmesi sağlanmaktadır.


Merkezimizdeki semen verme odası
Semen Analizi
Semen analizi çocuk sahibi olamayan çiftlerde ilk olarak değerlendirilmesi gereken ve sperm üretimi ile ilgili en faydalı bilgiyi veren bir testtir. Semen örneği, kısa sürede değerlendirmeye alınıp sadece bu konuda uzmanlaşmış deneyimli kişilerce yapılmalıdır. Semeni inceleyen kişinin deneyimsizliği bütün tedavi yaklaşımını değiştirebileceğinden, semen analizi kısırlık araştırmalarında çok önemli bir aşamadır. Bu test ile başlıca semendeki sperm sayısı, hareketliliği ve sperm şekli değerlendirilir. Semen analizi 3 ila 5 günlük cinsel perhiz sonrasında yapılır. Bu süre semenin değerlendirilmesi için oldukça önemlidir. Perhiz süresinin uzaması halinde sperm sayısı artar, sperm hareketliliği ve canlılığı azalır, sperm DNA’sının zarar görme ihtimali artar; perhiz süresinin kısa olması ise sperm sayının azalmasına ve sperm hareketliliğin artmasına yol açar, her iki şekilde de sonuç tedavi şeklinin belirlenmesinde yanıltıcı olabilir. Sperm üretimini sigara, alkol, ısı, ilaçlar ve enfeksiyonlar gibi birçok faktör etkilediği için normal olmayan örneklerin analizi en az 3 hafta ara ile iki veya üç kez tekrarlanmalıdır. Semen analizinde bir sorun ile karşılaşılır ise erkeğin fiziksel ve hormonal açılardan daha ileri muayenesi yapılmalıdır.
Erkekte sperm üretimi 62-90 gün arasında gerçekleşen bir süreçtir. Buna göre üretilen bir sperm yaklaşık 2-3 ay sonra semene salgılanacaktır. Aynı şekilde kişinin karşılaştığı zararlı etkenler veya tedavi için kullanılan faydalı ilaçlar da sperm üretimini 3 ayın sonunda etkileyebilir. Semen analizi sonuçlarını değerlendirirken bu süreç akılda tutulmalı ve hasta bu açıdan değerlendirilmelidir. Ancak, her 15 günde bir erkekte yeni bir semen yapım döngüsü başlar ve erkekte devamlı olarak sperm üretimi sağlanarak üreme kapasitesinin devamlılığı sağlanır. Bu nedenle eğer çevresel bir risk faktörü ve ilaç kullanımı yok ise üç hafta ara ile iki semen analizi yapılması sağlıklı bir değerlendirme için önemlidir.
Semen örneğini vermeden önce, dikkat edilmesi gereken önemli noktalar:
. Semen örneğini vermeden hemen önce mutlaka idrarın tamamen boşaltılması gerekir.
. Eller ve penis bölgesi, sabun ve bol su ile yıkandıktan sonra tamamen kurulanmalıdır.
. Örneğin toplanacağı steril kabın veya kapağının iç kısmına dokunulmamalıdır.
. Kayganlaştırıcı herhangi bir madde (sabun, yağ, vazelin, tükürük vs.) kullanılmamalıdır.
. Gelen meni örneğinin tamamının kabın içerisine verilmesi önemlidir. Özellikle örneğin ilk kısmı, semendeki spermin büyük çoğunluğunu kapsadığı için bu kısmın kaybı sonuçlarda ciddi değişikliklere yol açabilir. Bu durumda mutlaka görevlilere biyologlara bildirilmelidir.
Eğer hasta mastürbasyon yaparken zorluk çekiyorsa, biyolog tarafından verilen toksik etkisi olmayan kayganlaştırıcı madde kullanımına semen örneğine bulaştırılmamak koşulu ile izin verilir ya da çok özel durumlarda özel olarak üretilmiş sperme zarar vermeyen prezervatif kullanılması kaydı ile eşinden yardım alması sağlanır. Gerekli durumlarda Üroloji/Androloji doktoru görüşü alınarak eğer kullanmasında sakınca yok ise ereksiyon kolaylaştırıcı ilaçlar verilebilir. Burada özellikle dil altında emilen ve hızlı etkili ereksiyon kolaylaştırıcı ilaçların kullanılması tercih edilir. İlk örnek verme esnasında hastanın karşılaştığı psikolojik travma nedeni ile ilaçla dahi olsa ereksiyonu sağlama ve örnek verme zor olabileceği için hastaya tekrar uygun cinsel perhiz süresi içinde randevu ayarlanır.
Azoospermi olgularında ardışık semen analizi ile değerlendirme yapılmaktadır. Burada ilk örnek alındıktan sonra inceleme yapılmakta; eğer ilk değerlendirmede spermatozoa saptanmaz ise 30 dk. sonra tekrar bir örnek alınmaktadır. Bu yöntem doktorun talebine göre sperm sayısının az olduğu olgular, sperm hareket bozukluğu olan olgular gibi bazı özel durumlarda da uygulanabilmektedir. Bu nedenle ilk örneği verdikten sonra laboratuvardan ayrılmadan önce mutlaka sorumlu biyolog ile iletişime geçilmesi önemlidir.
Spermaozoanın izlenmediği tıkayıcı olmayan azoospermi (non-obstrüktif azoospermia=NOA) olgularında ışık mikrobunda inceleme sonrası spermatozoa saptanmaz ise örnek mikroenjeksiyon işleminde kullanılan özel mikroskoplarda (inverted mikroskop) incelenerek olgun (matür spermatozoa) veya daha erken evre sperm hücresi (elongated spermatid ve/veya round spermatid) varlığı değerlendirilir.
Meni miktarının az olduğu olgularda, obstrüktif (tıkayıcı) azoospermi veya meninin mesaneye geri kaçma durumunu değerlendirmek için sperm verme işlemi sonrası meni gelmese de idrar örneği alınarak mastürbasyon sonrası idrarda semen analizi incelemesi yapılabilir. Bu konuda laboratuvar personelinin size vereceği talimatlara dikkat etmeniz önemlidir.
Merkezimizde semen analizi Dünya Sağlık Örgütü (WHO) 2021 kılavuzu önerisine göre yapılmaktadır. Bu değerler aşağıda Tablo 1'de verilmiştir.
|
Tablo - 1: WHO 2021 Kılavuzu Önerisine Göre Semen Analizi Değerleri |
|
|
Volüm (ml) |
1,4 (1,3-1,5) |
|
Sperm sayısı (106/ml) |
16 (15-18) |
|
Total sperm sayısı (106) |
39 (35-40) |
|
Total motilite (ileri hareketli + yerinde hareketli sperm sayısı, %) |
42 (40-43) |
|
İleri hareketli sperm sayısı (%) |
30 (29-31) |
|
Vitalite (%) |
54 (50-56) |
|
Morfoloji (normal %) |
4 (3,9-4) |
|
Peroksidaz (+) lökosit (106/ml) |
<1.0 |
|
Tablo - 2: Semen Analizi Sonucunda Konulan Tanılar |
|
|
Normozoospermi |
Sperm sayısının, hareketliliğinin ve morfolojisinin normal olması |
|
Oligozoospermi |
Sperm sayısının normal değerlerden düşük olması |
|
Astenozoospermi |
Sperm hareketliliğinin normal değerlerden düşük olması |
|
Teratozoospermi |
Normal morfolojiye sahip sperm oranının normal değerlerden düşük olması |
|
Oligo-astenozoospermi |
Sperm sayı ve hareketliliğinin normal değerlerden düşük olması |
|
Asteno-teratozoospermi |
Sperm hareketliliği ve morfolojisinin normal değerlerden düşük olması |
|
Oligo-asteno-teratozoospemi |
Sperm sayı, hereketlilik ve morfolojisinin normal değerlerden düşük olması |
|
Şiddetli oligo-asteno-teratozoospermi |
Sperm sayısının <5 milyon/ml’den düşük olması aynı zamanda sperm hareketliliğinin ve morfolojisinin düşük olması |
|
Azoosperm |
Semende hiç sperm bulunamaması |
|
Virtual Azoospermi (Kriptozoospermi) |
Kişiye ait bazı örneklerde çok az sayıda <100bin/ml) sperm saptanırken, bazılarında sperm görülmemesi |
|
Total İmmotil Sperm |
Semendeki tüm spermlerin hareketsiz olması |
Sperm Morfolojisi (Şekli)
Sperm kalitesinin en önemli göstergelerinden biri de şeklidir. Semen analizinde değerlendirilen parametreler içerisinde spermin dölleme potansiyeli konusunda en önemli bilgiyi sperm hareketliliği ve sperm morfolojisi vermektedir. Sperm morfolojisi ile döllenme başarısı arasındaki ilişki birçok araştırmacı tarafından ortaya konmuştur.
Sperm morfolojisinin değerlendirilmesinde kullanılan yaygın 2 metot vardır; WHO kriterleri ve Kruger’in kesin kriterleri (Kruger’s strict criteria). Kruger’in kesin kriterleri, morfoloji konusunda çok daha detaylı bir inceleme imkânı sağlaması nedeniyle en çok kabul gören ve merkezimizde de kullanılan metottur.
Morfolojik değerlendirme için semen analizinde en az 200 sperm hücresi değerlendirilir. Özel bir boyama sonrası (Spermac) spermin şekil (morfoloji) özellikleri incelenerek sperm örneğinin fertilite (dölleme) kapasitesi belirlenir. Bu boya sperm çekirdeğini kırmızı renkte, akrozom, boyun ve kuyruğu ise yeşil renkte boyar. Semende spermlerin %4’ünden fazlasının normal şekle sahip olması gerekir. Eğer normal şekle sahip sperm sayısı %4’den az ise bu durum tüp bebek uygulamalarındaki başarıyı olumsuz yönde etkileyebilir. Normal sperm sayısının %4’den az olası “teratozoospermi” olarak ifade edilir.
Alt dağılımda sperm başına ait anomaliler şiddetli ve hafif olarak ayrılmaktadır. Merkezimizde Kruger kriterlerine göre şiddetli sperm baş anomalilerinin %80'den fazla görülmesi önemli kabul edilmektedir. Semen analizi sonucuna göre çifti bilgilendirirken bu durumu açıklamak önemlidir.
Sperm üretimi (spermatogenez) kompleks ve hassas bir süreç olup, genetik yapıya, vücudun iç ortamına ya da dış etkenlere bağlı olarak farklı aşamalarda meydana gelen bozulmalar teratozoospermiye neden olabilir.
Normal Sperm Morfolojisi: Sperm hücresi üç kısımdan meydana gelir: baş, orta kısım (boyun) ve kuyruk. Baş bölgesi dölleme sürecindeki en önemli bölümdür ve spermin genetik materyalini içerir. Boyun bölgesi, sperm hareketi için gerekli enerjiyi, kuyruk kısmı ise sperm hareketini (motiliteyi) sağlar. Normal bir spermin baş uzunluğu 4 ila 5 µm, eni 2.5 ila 3.5 µm, başın uzunluk/en oranı 1.50-1.75 olmalıdır. Orta kısım silindir şeklinde ve 0.5 µm-1µm kalınlıkta, 7-8 µm uzunluğunda ve başa düz olarak bağlanmalıdır. Kuyruk orta kısımdan biraz daha ince, kıvrımsız, düzgün biçimli ve yaklaşık 40-50 µm uzunluğunda olmalıdır.
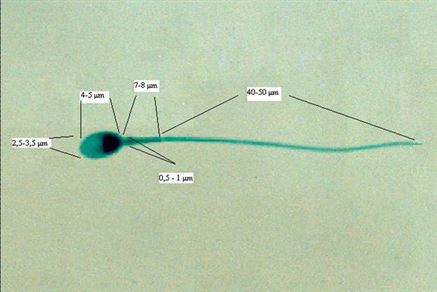
Normal Morfolojili Sperm Görüntüsü
Sperm Morfolojik Defektlerinin Sınıflaması:
Baş anomalileri:
Sınırda baş anomalileri: Hafif şekil bozuklukları olup normal sperm tanımlamasına tam olarak uymaz; ancak ilgili spermi belirli bir anormal form sınıfına da sokmaz. Başın hafifçe uzaması, oval şeklin bir miktar bozulması, baş eninin 1.5-2.0 µm olduğu halde normal bir akrozoma sahip olması durumunda ilgili sperm hafif amorf olarak değerlendirilir. Piriform olarak adlandırılan armut şekilli spermler de bu sınıfa girerler.
Şiddetli baş anomalileri:
Küçük baş: Sperm başı tanımlanan boyutlardan daha ufaktır.
Büyük baş: Sperm başı tanımlanan boyutlardan daha büyüktür.
Elonge (Uzun) baş: Sperm başı tanımlanan boyutlardan uzun olduğu halde akrozomal anomali eşlik etmez. Nükleer bölgede ise şiddetli bir şekil bozukluğu gözlenir. Düzenli olmayan uzun baş formasyonları fertilizasyon ve embriyo gelişimine negatif etki olarak yansıyabilmektedir.
Çok başlı formlar: Tamamlanmamış ve/veya immatürite (olgunlaşmamış form) gösteren sperm grubudur.
Serbest baş: Kuyruk ve boyuna sahip olmayan normal veya abnormal morfolojide sperm başlarıdır.
Pin-head: Sperm başının gelişmemiş olduğu, kromozomal yapı içermeyen sperm grubudur.
Tapered sperm: Sperm başının uzun ve sivri olması durumudur. Akrozom anomalisi bu duruma eşlik eder.
Round Head: Sperm başı genellikle dışı yeşil içi pembe boyanmış şekilde görülür ve bu örnekler “globozoospermi” olarak adlandırılır. Baş tümüyle oval formasyondadır ve akrozomal içerik kaybolmuştur. Bununla birlikte orta kısım (mid-piece) düzensizliği, zonaya bağlanma yeteneğinin yoksunluğu, nüklear dekondansasyon yetersizliği söz konusudur. Yüksek oranda fertilizasyon düşüklüğüne sebep olan bir sperm baş anomalisidir.
Head-base vakuol: Sperm başında boya almayan boşluklardır. Normal bir sperm ikiden fazla vakuol içermemelidir.
Abaksiyel implantasyon: Sperm başı ile orta kısım aynı aks üzerinde değildir.
Akrozom Anomalileri:
Primer akrozomal anomalileri: Spermin gelişmesi ve farklılaşması sırasında meydana gelen anomalilerdir. Anormal formasyon, anormal dağılım ve sperm başında anormal bağlanma şeklinde ortaya çıkar.
Akrozomal kistler: Primer akrozomal anomalilerdir. Spermac boyama ile akrozom bölgesinde boya almayan parlak alanlar veya çıkıntılar şeklinde görünür.
Nipple akrozom: Akrozomun en uç kısmında yer alan kistlerdir.
Aberan akrozom: Homojen olmayan boya dağılımı ve kontur bozukluğu vardır.
Sekonder akrozomal anomalileri: Sperm membranının eksternal etkenler, yaşlanma ve harabiyete bağlı olarak akrozom içeriğinin kaybıdır.
Membran bozulması: Akrozom konturlarının düzenli olmaması durumudur.
Küçük akrozom: Akrozomun sperm başının %40'ından daha azını kaplamasıdır.
Büyük akrozom: Akrozomun sperm başının %70'inden daha fazlasını kaplamasıdır.
Ayrılmış akrozom: Akrozomun sperm başından hafifçe uzaklaştığı görülür.
Nükleus Anomalileri:
Nükleus vakuolleri: Çekirdek içinde boşluk alanlar vardır.
Nükleus kistleri: Spermac boya ile boyanmış pembe kısımda yer alan parlak ve çıkıntılı kısımlardır.
Diadem defekti: Sperm başının ekvatoryal sınırına yakın veya üzerinde yer alan çöküntü alanları ve nükleus içine doğru olan girintiler mevcuttur.
Yarık (ridged) baş: Aynı sperm başı içinde birden fazla nükleus bulunması durumunda görülür.
Kuyruk anomalileri:
Kısa kuyruk: Normalde olması gereken 40µm’den daha kısa kuyruk yapısına sahip spermlerdir. Ayrıca kuyruktaki normal 9+2 mikrotubül yapısı da izlenmez. Bunun yerine 9+0 ve 9+1 mikrotübüler dizilim vardır. Ayrıca, dynein bağlantı kolları yoktur.
Uzun kuyruk: 50 µm’den daha uzun kuyruk yapısına sahip spermlerdir.
Tail-stump: Kısa ve küt görünümlü sperm yapısına sahip spermlerdir. Kısa kuyruktan farklı olarak bu olgularda genelde 9+0 ya da normal 9+2 mikrotübüler dizilim izlenir. Ayrıca, dynein bağlantı kollarına sahiptirler.
Dag defekti: Kuyruğun baş ve orta kısım etrafında kıvrılmasıdır. Kuyruğun hafif kıvrılması, başın etrafında dolanması (orta derecede dag), tam anlamıyla başın etrafında heliks oluşturması (ileri derecede dag) gibi değişik formasyonlarını izlemek mümkündür.
Çoklu Kuyruk Defekti: Tek bir başa ait birden fazla kuyruğun gözlemlendiği anomali grubudur.
Şiddetli Sperm Morfolojik Defektler: Dünya genelinde tüm çiftlerin yaklaşık %15’inde birincil veya ikincil dereceden infertilite sorunu mevcuttur ve infertil çiftlerin yarısına yakınında erkek kaynaklı problemler asıl infertilite nedenini oluşturmaktadır. Günümüzde, tüp bebek uygulamasında kullanılan sperm hazırlama teknikleri, intrasitoplasmik sperm enjeksiyonu (ICSI) ve son zamanlarda çok etkin olarak kullanılmaya başlanan intrasitoplazmik morfolojik olarak seçilmiş sperm enjeksiyonu (IMSI) erkek kaynaklı infertilite sorununa büyük ölçüde çare olmaktadır.
Sperm morfolojik anomalilerinin şiddetli olanları spermin dölleme kapasitesini değişik oranlarda olumsuz etkilemektedir. En önemli anomaliler büyük baş (Megalo head, Makrosefali), yuvarlak baş (Round head, Globozoospermia) ve kuyruğa ait anomali olup sperm baş bölgesinde de anormallikle birlikte görülen Tail-stump sendromlarıdır. Bu anomaliler, mevcut oldukları örneklerde yüksek oranda bulunmaları ve dolayısıyla normal sperm seçiminin çoğunlukla mümkün olamaması nedeniyle yüksek döllenme başarısızlığı, kötü ve / veya yavaş embriyo, blastosist gelişimi görülebilir.
Büyük Baş (Makrosefali, Megalo head): Sperm başının normal boyutlardan büyük, çoğunlukla düzensiz yapıda ve multinükleer (çok çekirdekli) olması durumudur. Çoğunlukla birden çok başın ve kuyruğun bir arada olduğu (polyploid, makronükleer) düzensiz formlar olarak göze çarpar. Büyük başlı spermlerde yapılan kromozomal incelemelerde bu tip spermlerin kromozomal içeriğinin bölünme kusurlarından dolayı, olması gerekenden daha fazla olduğunu gösterilmiştir. Normal spermde 1N olarak gösterilen kromozomal içerik büyük başlı spermlerde, katlanarak 2N, 3N (polyploid) hatta daha fazla olabilmektedir. Ayrıca bu spermlerde bir veya daha fazla kromozomda anormal sayısal değişiklikler (yüksek anöploidi) saptanmaktadır. Bu nedenle yüksek oranda büyük başlı spermi olan vakaların spermleriyle yapılan enjeksiyonlarda düşük fertilizasyon ve gebelik oranları yanı sıra embriyolarda yüksek oranda kromozomal anormaliler ile karşılaşılmaktadır.
İlk olarak 1977 yılında tanımlanan spermlerdeki büyük baş sendromu, ejakülatta çok yüksek oranda büyük başlı, ileri derecede baş anormallikleri olan ve birden fazla kuyruğu olan spermlerin varlığı ile tanımlanmaktadır. Makrosefali (Büyük Baş) olarak bilinen bu sendrom şiddetli erkek infertilitesi olan vakaların %1’den daha azında görülmektedir.
Son yapılan çalışmalar, ejakülatında yüksek oranda büyük baş anomalisine sahip sperm bulunan vakalarda, normal baş yapısına sahip sperm bulunsa dahi, bunların kromozomal olarak anormallikler içerme ihtimalinin çok yüksek olduğunu göstermektedir. Bunun sebebi de spermin oluşması esnasında fonksiyonel olan genlerden birinin bozuk olması, yani genetik bir problemin olmasıdır. Bu anomalinin mevcut olduğu örneklerde başsız (pin-head) spermlere de sıklıkla rastlanır.
2007 yılında 10 infertil erkekte yapılan bir çalışmada, sperm mayoz bölünme mekanizmasında önemli rolü olan bir gen bölgesindeki "Aurorakinase c" eksikliğinin; infertiliteye neden olduğu saptanmıştır. Genetik faktörün yanı sıra dış etkenler nedeniyle veya zamanla spermin mayoz bölünme mekanizmasında meydana gelebilecek problemlerin de sorumlu olabileceği öne sürülmektedir.
Bu anomalinin baskın olduğu örneklerde aynı zamanda sperm sayısı, hareketliliği ve canlılığının da düşük olması nedeniyle yeterli sperm elde edilebilmesi için bazen cerrahi yola (Mikroskopik Testiküler sperm ekstraksiyonu, Mikro TESE) başvurulması gerekebilmektedir.
Yapılan çalışmalarda bu spermler ile elde edilen embriyolarda yüksek oranda kromozomal anomali ortaya çıktığında spermlerdeki genetik yapının değerlendirilmesi için yardımcı üreme tekniği öncesinde tanısal amaçlı spermlerin kromozom incelemesi (sperm FISH testi) yapılabilir. Ayrıca bu spermlerle yapılan mikroenjeksiyon sonrasında döllenme başarısızlığı, kötü embriyo gelişimi, embriyolarda yavaşlama veya duraksama, düşük gebelik oranları ve yüksek ölçüde gebelik kayıpları gözlenmektedir. Bu nedenle, kaliteli embriyo seçimi için bu vakalarda uygulanan bir diğer önemli yaklaşım ise merkezimizde de başarılı şekilde gerçekleştirilen preimplantasyon genetik tanının (PGT) uygulanmasıdır. Bu sayede hem kromozomal olarak hem de genetik olarak normal embriyoların anne adayına transfer edilmesi mümkün olmaktadır.
Merkezimizde yaptığımız ve bilimsel olarak yayınladığımız çalışma ile yüksek oranda büyük baş anomalisi olan vakalarda, ICSI işleminde ejakülatlarından detaylı inceleme ile seçilen göreceli olarak daha normal baş yapısına sahip spermler kullanılmış ve gelişen embriyolar yapılan genetik tanı (PGT) ile kromozomal olarak incelenmiştir. PGT sonrası kromozomal olarak normal olan embriyoların anne adaylarına transfer edilmesi ile daha yüksek gebelik oranları elde edilmiştir. Bu çalışmadaki önemli bulgulardan biri de incelenen embriyolarda, büyük baş sperme bağlı kromozomal anormali artışının saptanmış olmasıdır.
Bu sendroma sahip vakalarda, az sayıdaki normal veya göreceli normal spermlerin seçilmesi çok önemlidir. Bu amaçla MSOME tekniğinde kullanılan yöntemle sperm 8050 kez büyütülmekte ve sperm baş yapısı daha iyi değerlendirilerek normal yapıda ve vakuol içermeyen spermlerin seçimi mümkün olmaktadır. Bu yöntemle uygulanan mikroenjeksiyon işlemi IMSI (yüksek büyütme sperm seçimi ile mikroenjeksiyon uygulaması) olarak adlandırılmaktadır. Günümüzde makrosefal yada çok büyük başlı spermlerin ağırlıklı olduğu örneklerde IMSI yöntemi ile sperm seçimi ve mikroenjeksiyon en yararlı yöntemdir. İlave olarak PGT yöntemiyle kromozomal anomalili embriyoların elenmesi sağlıklı gebelik şansını arttırmaktadır.
Bahsedildiği gibi, büyük baş sperm sendromu, tüp bebek kliniklerinin karşılaştığı en zorlu şiddetli erkek infertilite endikasyonlarından biridir. Merkezimizde, bu sendromlu vakalar, tedavi öncesinde, özellikle spermlerinde bulunma ihtimali yüksek olan kromozomal anormallikler ve gen mutasyonu açısından detaylı olarak bilgilendirilmektedir. Ayrıca olası düşük fertilizasyon, kötü embriyo gelişimi ve düşük gebelik oranları detaylı şekilde anlatılmaktadır. Etkinlikleri yapılan çalışmalarla da gösterilen IMSI ve PGT özellikle bu vakalara önerilmektedir.

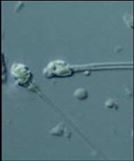
8050 kat büyütmeyle büyük baş ve birden
fazla kuyruğa sahip sperm görüntüsü
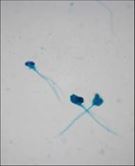
Spermac boya ile boyanmış büyük başlı ve
birden fazla kuyruğu olan sperm görüntüleri
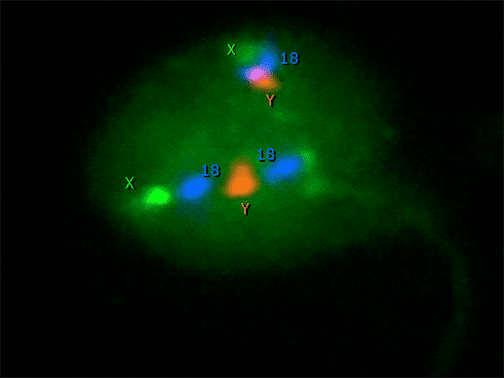
Kromozomal analizi yapılmış büyük başlı spermde kromozomdaki
sayısal artış (poliploid sperm)
Yuvarlak başlı spermler, akrozom kısmına sahip olmamaları ve spermin iskelet yapısındaki problemler sebebiyle normalde oval olan ve akrozom kepi içeren baş yapısının bozulması ile oluşur. Akrozom, spermin yumurtayı çevreleyen zona tabakasına bağlanmasını ve içerdiği eritici enzimler sayesinde bu tabakayı geçerek spermin yumurtaya girişini sağlayan yapıdır. Dolayısıyla yokluğunda spermin normal yoldan yumurtayı döllemesi mümkün olmamaktadır. ICSI yöntemiyle bu problem aşılmaktadır. Ancak, sperm DNA yapısındaki problemlerin eşlik etmesi sebebiyle ICSI işlemine rağmen dölleme kapasitesi düşüktür.
Olgun bir spermin DNA iplikçikleri (kromatin) çekirdeğin içerisinde gevşek bir şekilde paketlenmiş haldedir (olgun DNA). Fakat yuvarlak başlı spermlerde bu yapı sıkı bir şekilde paketlenmiş durumda olduğundan (immatür DNA) yumurta içerisinde spermin DNA iplikçikleri açılamaz ve sonuç olarak döllenme gerçekleşemez. Ayrıca bu formlarda, spermin sentrozom denen ve döllenme esnasında kromozomların hareketinden sorumlu yapıları (iğ iplikçikleri) oluşturan parçasının da hasarlı olduğu ve bu nedenle döllenmenin gerçekleşemediği öne sürülmektedir. Birçok çalışmada bu spermlerin DNA’larında yüksek oranda kırıklar (fragmantasyon) olduğu gösterilmiştir.
İki tip Globozoospermi tanımlanmıştır. Tip I’de spermlerin tamamına yakını yuvarlak başlı spermlerden oluşmaktadır ve akrozom yoktur. Tip II’de ise koni şeklinde bir başla beraber düşük oranda akrozoma sahip spermler görülebilir, ayrıca hareket düşüklüğü eşlik etmektedir.
Bu bozukluktan sorumlu genler tam olarak belirlenememiş olmakla birlikte genetik geçişli olduğunu gösteren çalışmalar mevcuttur. Yuvarlak başlı spermler üzerinde yapılan sperm FISH incelemelerinde normal spermlere kıyasla artmış anöploidi (sayısal kromozom anomalisi) oranları saptanmıştır. Genel olarak Globozoospermi vakalarında düşük oranda döllenme ile kötü embriyo gelişimi, düşük gebelik oranları ve gebelik kayıplarında artış söz konusudur. Nadiren hiç döllenme göstermeyen vakalar izlenmektedir.
Bu vakalarda merkezimizde uygulanan IMSI yöntemiyle akrozom içeren spermlerin daha etkin bir şekilde tespit edilerek mikroenjeksiyon için kullanılması başarı şansını arttırmaktadır.
|
|
|
|
8050 kat büyütmeyle |
Spermac boya ile boyanmış |
|
|
|
|
Round head |
Ridged |
|
|
|
|
Serbest Baş |
Multiple Baş ve Kuyruk |
|
|
|
|
Kırık Boyun |
Kıvrık Kuyruk |
|
|
|
|
Dagdefekt |
Çift Kuyruk |
|
|
|
|
Pinhead |
Tail-Stump |
MSOME (Motile Sperm Organelle Morphology Examination) tekniği, hareketli spermlerin 6000-8050 kat büyütebilen donanımlı mikroskoplar ile yapılan sperm morfoloji analizidir.
Sperm morfolojisinin değerlendirilmesi erkek üreme potansiyelinin ve tedavi stratejisinin belirlenmesinde önemli rol oynar. Bugüne kadar yapılan birçok bilimsel çalışmalar ile sperm morfolojisinin döllenme, embriyo gelişimi ve gebelik sonuçları üzerinde önemli etkisinin olduğu gösterilmiştir. Erkek infertilitesinin teşhisindeki ilk aşama semen parametrelerinin (spermiogram) değerlendirilmesidir. Semen analizi sonucuna göre normal sperm oranı düşük olan vakalarda, şiddetli erkek faktörü nedenli infertilite durumlarında spermler MSOME (Motile Sperm Organelle Morphology Examination) tekniği ile değerlendirilir ve yardımcı üreme yöntemlerinde kullanılmak üzere sperm seçimi yapılarak bu yöntemle mikro enjeksiyon işlemi IMSI yöntemi gerçekleştirilir.
MSOME ile sperm değerlendirilmesinde majör sperm anomalilerinin yanında spermin başı içerisindeki anomalili yapıları ve vakuolleri (sıvı dolu kesecik) ayırt etmek mümkündür. Sperm başı içerisindeki genetik materyali içeren çekirdek kısmında bulunan vakuoller DNA yapısında hasar bulunabileceği konusunda ipucu vermektedir. Yapılan araştırmalarda vakoul içeren spermlerde vakuol içermeyenlere nazaran DNA hasarı oranının daha yüksek olduğu gösterilmiştir. Sperm DNA yapısındaki hasarlar, döllenme başarısızlığı, embriyo gelişiminin durması, kötü ve/veya yavaş embriyo gelişimine sebep olabilmekte ve dolayısıyla gebelik şansını olumsuz etkilemektedir.
MSOME tekniği ile sperm morfolojisi değerlendirilirken aynı zamanda boyun ve kuyruk yapıları normal olan spermler içerisinde baş yapısı, baş içerisinde vakuol varlığı ve vakuollerin boyutlarına göre 4 aşamalı bir kalite değerlendirmesi yapılır. Bu değerlendirmeye göre normal morfolojiye sahip ve baş içerisinde vakuol bulunmayan spermler 1.kalite olarak tanımlanırken, vakuol sayısı ve boyutunun artışına bağlı olarak sperm kalitesi düşmektedir. Baş yapısı normal olmayan ve vakuol içeren spermler ise 4. kalite olarak tanımlanmaktadır.

8050 büyütme (Yüksek büyütmede
sperm sınıflandırması)
Merkezimizde aşağıdaki durumlarda MSOME değerlendirmesi temel semen analizi yanında mutlaka yapılmakta ve bu olgularda IMSI tekniği ile mikro enjeksiyon işlemi gerçekleştirilmektedir. IMSI uygulaması önerilen durumlar şunlardır:
Erkek faktör infertilitesi
Önceki başarısız implantasyon varlığı
Yüksek DNA hasarı olan olgular
Tekrarlayan gebelik kaybı olan olgular
Erkek genetik faktör varlığı
Semen örneğinde gözlenen aglütinasyon (kümeleşme), çoğu kez anti sperm antikorların varlığı ile ilişkilidir. Anti sperm antikorlar sperm yüzeyinin birçok değişik bölgesine yerleşip, spermlerin rahim içine giriş yolunda hareketliliğini olumsuz etkiler. İnfertilite olgularının %8’inde immünolojik faktörler mevcuttur. Aglütinasyon içeren örneklerin izah edilemeyen infertilite ile ilişkili olduğu öne sürülmektedir.
Özellikle infertilite nedenin immünolojik nedenlere bağlı olduğu düşünülüyorsa immünolojik testlerin yapılması önerilir. Semen Analizinde spermlerde aglütinasyon (spermlerin birbirine baş, boyun, kuyruk bölgelerinden bağlanması) gözlendiği ve düşük sperm hareketliliği izlenilen durumlarda bu testler uygulanır.
Merkezimizde immünolojik sperm testi olarak Sperm MAR testi uygulanmaktadır.
Bu test ile taze semendeki spermde IgG ve IgA antikorları saptanır. Test, lateks kaplı immünoglobülinlerden oluşmaktadır. Özel olarak hazırlanmış solüsyonlar içindeki lateks partikülleri hareketli taze sperm örneği ile karıştırılır. Bu uygulama sonrası lateks partikülleri spermlerin değişik bölgelerine (baş, mid-piece veya kuyruk) bağlanır. Bağlantı gözlenen hareketli spermler ışık mikroskobunda bağlantı noktaları belirtilmek suretiyle sayılarak yüzde olarak değerlendirilir.
Hareketli sperm ile lateks partikülü (bead) arasındaki etkileşim, anti sperm antikorların varlığını gösterir. Değerlendirmede %15’ten az bağlanma normal kabul edilir. %15-39 arası değerler şüpheli infertiliteyi, %40 ve üzerindeki değerler ciddi bir immünolojik problemin varlığını göstermektedir.
Semen analizinde hareketli sperm oranı %40'ın altında olduğu olgularda sperm canlılığının değerlendirilmesi uygundur. İstanbul Memorial Hastanesi Androloji Laboratuvarında bu amaçla iki test yapılmaktadır:
Eozin-Y Testi: Tanısal amaçlı kullanılan bu test sağlıklı spermlerin hücre zarının geçirgenlik özelliğine dayanmaktadır. Bu değerlendirme sonrası canlı olduğu saptanan spermler yardımcı üreme yönteminde kullanılamazlar. Çünkü, bu uygulamada spermler özel bir boya ile boyanmakta ve boyanma durumlarına göre canlılıkları derecelendirilmektedir.
Özel olarak hazırlanmış Eosin-Y solüsyonu ile karıştırılan taze semen örneği ışık mikroskobunda incelenir ve 200 hücre sayılarak canlılık oranı yüzde olarak hesaplanır. Ölü sperm hücrelerinin hücre yüzeyleri bozulduğu için Eosin Y boyasını hücreye alırlar ve incelemede pembe/kırmızı renkte görülürler. Buna karşın sağlıklı hücreler hücre yapıları sağlam olduğu için boyanmaz ve beyaz parlak olarak izlenir.
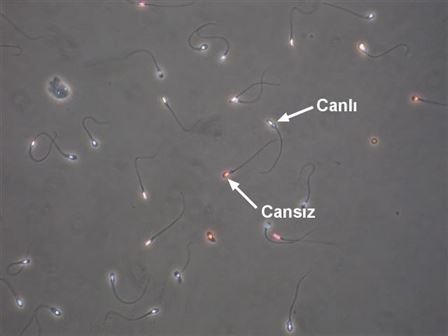
Eozin-Y uygulaması sonrası pembe boyanan cansız ve boya
almamış canlı spermler.
Hipo-Ozmotik Şişme Testi (HOST): Bu test de aynı amaçla sperm canlılığını değerlendirmek için uygulanır ve Eosin Y testinde olduğu gibi sperm hücre zarının sağlıklı olup olmaması ilkesine dayanır. Ancak, bu testtin en önemli avantajı bu yöntemle yapılan değerlendirme sonrası canlı olduğu saptanan spermlerin toplanarak yardımcı üreme yöntemlerinde kullanılabilmesine olanak sağlamasıdır. HOST testi hem bir tanısal test hem de bir sperm seçim yöntemi için uygulanan testtir.
Bu yöntemde yine taze sperm örneği özel olarak hazırlanmış hipoosmotik solüsyon ile karıştırılarak bir süre 37°C’de bekletilir. Daha sonra yine ışık mikroskobunda değerlendirme yapılır. Sağlıklı sperm hücreleri içinde bulundukları hipoozmotik sıvıyı hücre içine alarak baş bölgesinde şişme ve beraberinde kuyruk bölgesinde kıvrılma özelliği gösterirler. Bu şekilde olan spermler canlı olarak kabul edilir ve yardımcı üreme yöntemlerinde kullanılabilir. Buna karşın sıvı içeri almayan ve baş bölgesinde değişim izlenmeyen, kuyruk yapıları düz bir şekilde uzanan spermler ise ölü spermlerdir. Değerlendirme 200 sperm hücresi sayılarak yapılır ve canlılık oranı yüzde olarak ifade edilir.
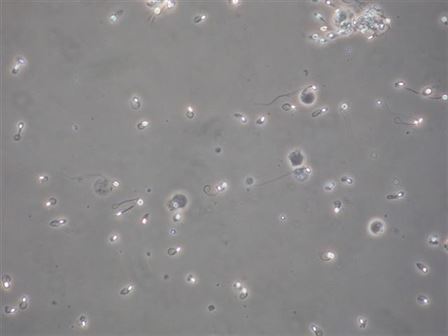
Hipo ozmotik şişme gösteren ve kuyrukları kıvrılan spermler canlı,
şişme göstermeyen ve kuyrukları kıvrılmayan spermler cansız.
Sperm hareketi esas olarak düzgün bir kuyruk yapısının bulunması yanı sıra bunu harekete geçirecek olan bazı moleküllerin de (cAMP, kalsiyum (Ca), vb.) yeterli olması ve düzgün dağılımına bağlıdır. Gerekli durumlarda sperm hareketi in vitro şartlarda uyarılarak spermin hareketi ve canlılığı değerlendirilmektedir. Bu amaçla Pentoksifilin veya Teofilin testi uygulanmaktadır. Merkezimizde gerek tanısal semen analizi sırasında gerekse YÜT için sperm seçimi sırasında hareketsiz spermlerin hareket kazanması amacı ile Teofilin uygulaması yapılmaktadır. Bu yöntemde hazır Teofilin solüsyonundan 100 µl alınarak üzerine sperm hazırlaması sonrası elde edilen örnekten aynı miktarda konularak bir süre bekletilir ve spermlerin hareket kazanması izlenir. BU işlem aynı zamanda dondurulmuş spermlerin çözme sonrası hareketlerinin değerlendirilmesi için de uygulanır.
Normal bir semen mililitrede 1 milyondan daha fazla lökosit (akyuvar/iltihap hücresi) içermemelidir. Semende normalden fazla lökosit görülmesi (lökospermi), üreme organlarında bir enfeksiyon varlığını düşündürür. Lökosit sayısının normalin üzerinde gözlendiği semen örneklerinde, sperm değerleri olumsuz yönde etkilenmektedir. Artmış lökosit oranı spermdeki toksik ürünlerin (reaktif oksijen ürünleri) ve sperm DNA hasarının en önemli nedenidir. Merkezimizde semen analizi yapılırken mikroskopta görünen lökositlerin varlığı, mutlaka lökositlerin tanımlanması amacıyla üretilmiş hazır kit solüsyonlarıyla teyit edilmektedir.
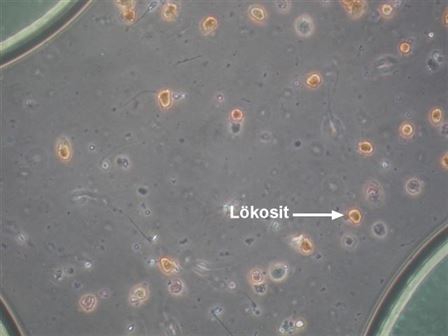
Kahverengi yuvarlak hücreler hazır kit ile belirlenmiş lökositlerdir
Lökosit varlığında hastanın öyküsü ve klinik bulgular da uyumlu ise PCR ile nonspesifik ve spesifik mikrobiyolojik inceleme yapılması uygundur. Aksi takdirde klinik anlamı olmayan lökospermi de ileri tetkik gerekli değildir. Antioksidan ajanlar ve sperm hazırlık yöntemleri ile ortamdaki lökositlerin etkisi ortadan kaldırılabilir.
Semen örneğinde gelişimini tamamlamamış üreme hücrelerinin sayısının mililitrede 5 milyon veya altında olması beklenir. Özellikle sperm sayısının çok düşük olduğu olgularda ya da azoospermide bu hücrelerin değerlendirilmesi, sperm üretiminin saptanması açısından önemlidir.
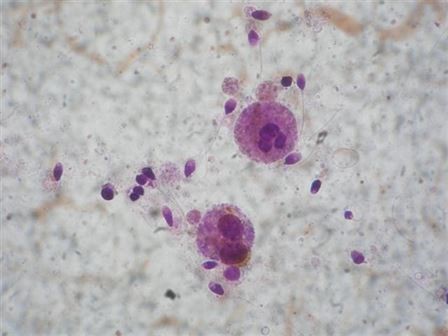
Merkezimizde Bryan-Leishman boyaması ve hazır boyalı lamlardan
oluşan Test-simplet kiti ile bu hücreler tanımlanabilmektedir.
Ejakülatta Round Spermatid ve Elongated Spermatid Aranması:
Azoospermi menide sperm bulunmaması durumudur ve infertilite nedeni ile başvuran çiftlerde %10-15 oranında izlenmektedir. Tıkayıcı azoospermi (obstrüktif azoospermi) olgularında testiste sperm vardır; ancak çeşitli nedenlere bağlı olarak sperm çıkışı engellenmektedir. Tıkayıcı olmayan azoospermi durumunda ise testiste sperm yapımı yok veya dışarı çıkacak yoğunlukta olmayacak kadar azalmış durumdadır. Bu olgularda standart yaklaşım Mikro TESE olmakla birlikte olguların %40-50’sinde sperm elde edilememektedir.
Testiste sperm kanalları içinde ana sperm hücresinden olgun sperm hücresine ulaşana kadar farklı gelişim aşamalarında öncül sperm hücreleri vardır. Bir ana hücreden olgun sperm hücresine ulaşana kadar geçen süre 64-72 gün arasında değişmektedir. Farklı gelişim evrelerindeki bu hücrelerin hepsi sperm kanalları içinde değişik bölmelerde bulunmaktadır. Sperm öncül hücreleri ilk aşamada 46 kromozom yapısı içerirken gelişimleri sürecinde genetik bölünmeye uğrar ve kromozom sayısını yarıya indirirler. Böylece bir kısmında 23, X ve bir kısmında ise 23, Y kromozom yapısı bulunur. Bu aşama tamamlandıktan sonra sperm kendi yapısal gelişimini tamamlama ve olgunlaşma aşamasına girer ve sperm kuyruğu oluşmaya başlar.
Sperm kuyruğu oluşmadan hemen önceki aşamada, kromozom yapısının yarıya indiği evredeki hücreler yuvarlak sperm hücreleri (round spermatid); spermin kuyruk oluşumun başladığı hücreler ise elongated spermatid olarak adlandırılmaktadır.
Mikro TESE’de sperm elde edilemeyen olguların %20’sinde son yıllarda ROSI yöntemi alternatif bir yaklaşım olarak sunulmaktadır. Bu yöntemde henüz olgunlaşmasını tamamlamamış, kuyruk gelişimi olmamış ve spermatid olarak adlandırılan erken evre yuvarlak sperm hücreleri yardımcı üreme tekniklerinde kullanılmaktadır. Ancak bu olgularda ROSI uygulaması öncesi sonuçlar hakkında hastaların son derece detaylı bilgilendirilmesi gereklidir.
Bu amaçla merkezimizde gerek daha önce dış merkezde yapılmış semen analizi olan gerekse daha önce Mikro TESE ile sperm elde edilememiş tüm olgulardan ardışık semen analizi ile ejakülatta round ve elongated spermatid incelemesi yapılmaktadır. Hastalardan alınan ejakülat örneği standart semen analizi yöntemi ile incelenmesi sonrası sperm hücresi saptanmaz ise mikroenjeksiyon işleminde kullanılan özel mikroskoplar (Inverted mikroskop) altında tekrar değerlendirme yapılmakta ve round ve/veya elongated spermatid varlığı değerlendirilmektedir. Bu hücreler normal sperm hücresinden şu kriterler ile ayrılır:
Diğer yuvarlak hücrelerden daha küçüktürler (6.5-8µm)
Normal sperm hücresinin baş kısmında bulunan ve spermin oosit ile birleşmesinde ve onu döllemesinde önemli rol oynayan akrozom adı verilen bölge henüz oluşmamıştır
Akrozom henüz hücre içinde parlak bir nokta şeklinde görülür
Hücrenin yüzeyi düzgündür
Round spermatid aşamasında kuyruk yoktur
Elongated spermatid aşamasında ise kuyruk yapısı uzamaya başlamıştır
Spermatidler ışık mikroskobu ve elektron mikroskopisi altında 4 aşamada sınıflandırılır:
A: Golgi fazı
B: KAP fazı
C: Akrozomal fazı
D: Olgunlaşma fazı- Hematoksilen ve eosin ile boyanmış histopatolojik olarak akrozomal yapıyı görselleştirmekteki zorluk nedeniyle spermatidler nükleer şekil ve pozisyona göre 6 aşamaya ayrılmıştır:Sa,Sb1,Sb2,Sc.Sd1,Sd2 bu sınıflamala doğrultusunda ;
Literatürde spermatidler 4 kategoriye ayrılır:
1) Yuvarlak spermatidler (aşama Sa ve Sb1)
2) Uzamış spermatidler (aşama Sb2)
3) Uzamış spermatidler (aşama Sc ve Sd1)
4) Olgunlaşmamış spermatozoa Sd2
Sa-Sb1: Round spermatid diğer yuvarlak hücrelerden küçük olmasıyla ayrılır. (6,5 um-8um). Akrozomal veziküllerin ortaya çıkmasıyla başlar oluşan akrozomal yapı parlak bir nokta şeklinde görülebilir. Yüzeyi düzgündür kuyruk yoktur. Sb1 de kuyruk uzamaya başlamıştır. (Golgi fazı)
Sb2: Uzamış spermatidler bir spermatozoonun kafasına benzeyen koyu yoğunlaşmış çekirdeğe sahiptirler. Sitoplazma çekirdeğin etrafında eksantrik bir görünüm alarak karakteristik olarak dondurma külahına benzer.
Sc-Sd1: Erken oluşan kuyruğu çevreleyen sitoplazmadan kısmen çıkıntı yapan belirgin oval bir çekirdeğe sahiptirler. Akrozomal vezikül düzleşmiştir. Yuvarlak baş, uzamış nukleus ve oluşan boyun kısmı dikkat çeker.
Sd2: Uzamış baş, uzamış nukleus ve stoplazma nukleusdan tamamen ayrılmış olgun spermatid evresi.
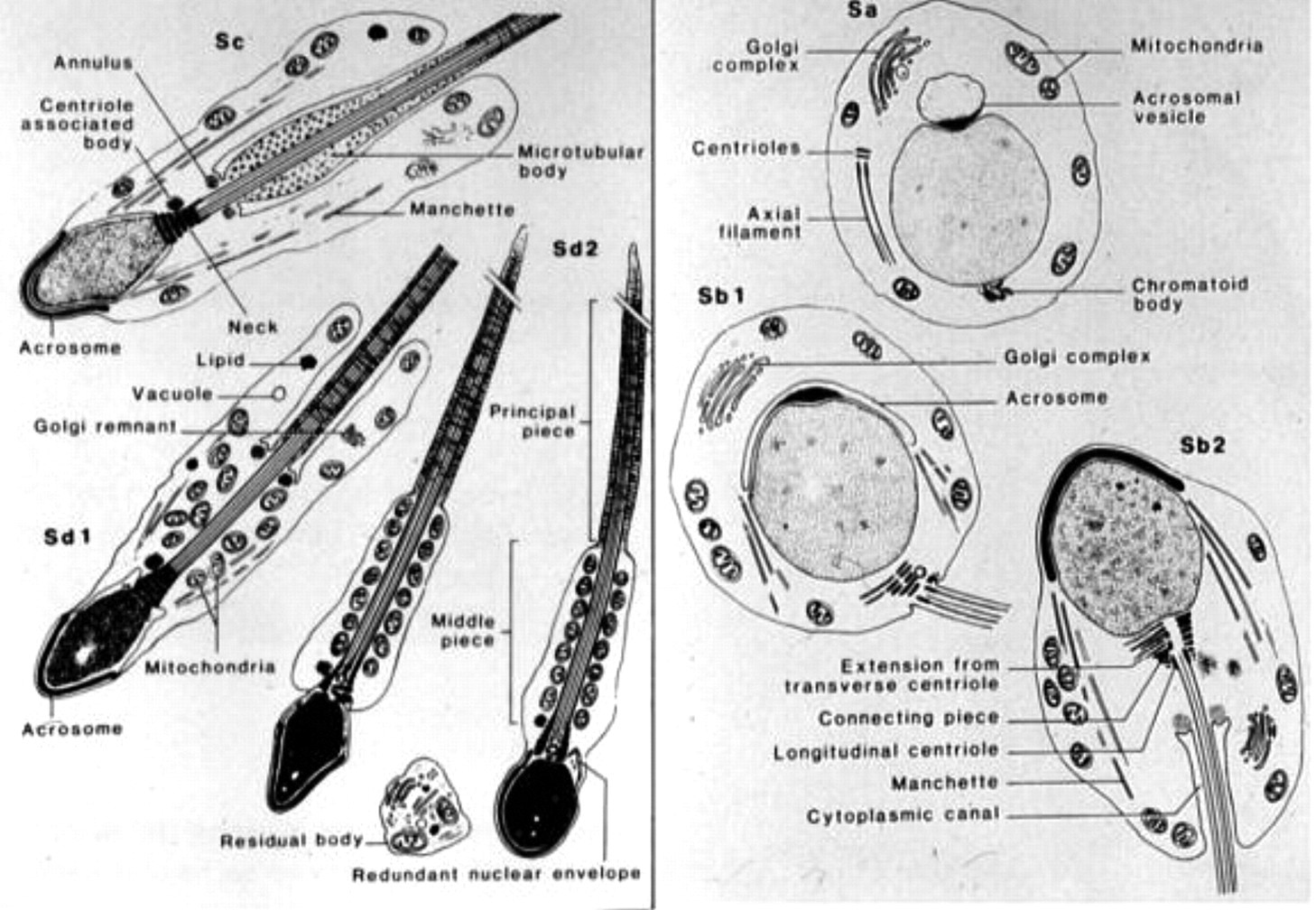
(Spermatid evrelerinin şematik olarak gösterilmesi)
|
|
|
|
A: Round Spermatid Sa |
B: Round Spermatid Sa (dış membran netleşmiş, dış membran ayrılmaya başlamış) |
|
|
|
|
C: Round spermatid Akrozomal yapı parlak, yüzey düzgün, kuyruk uzamaya başlamış |
D: Elongating Spermatid Sb2 (spermatozoon kafasına benzeyen koyu yoğunlaşmış çekideğe sahiptirler) |
|
|
|
|
E: Elongating Spermatid Sb2 (spermatozoon kafasına benzeyen koyu yoğunlaşmış çekideğe sahiptirler) |
F: Elongating Spermatid Sc (Dondurma külahına benzerler) |
|
|
|
|
G: Elongating Spermatid Sc (uzamış baş, uzamış nukleus, boyun kısmi oluşmuş) |
H: Elongating Spermatid Sc, Elongated Spermatid Sd1 |
|
|
|
I: Elongated Spermatid Sd2 (uzamış nukleus, uzamış baş, boyun oluşmuş, sitoplazma nuklueusdan ayrılmış; olgun spermatid) |
(RESİMLER ŞİŞLİ MEMORİAL HASTANESİ
EMBRİYOLOJİ LABORATUVARI'NA AİTTİR)
Sperm hazırlama yönteminin IUI (İn Utero İnseminasyon=Aşılama), IVF (İn Vitro Fertilizasyon=Tüp bebek) ve ICSI (İntrasitoplazmik Sperm Enjeksiyonu=Mikroenjeksiyon) işlemlerinde başarıyı artırmada çok büyük rolü bulunmaktadır. Spermlerin seminal plazma içerisinde uzun süre bekletilmesinin fertilizasyonu (döllenme) negatif etkilediği yapılan çalışmalarla gösterilmiştir. Ayrıca, spermlerin bu ortamda bekletilmesi hem ortamda bulunan toksik madelerin sperm üzerine olan negatif etkisini artırmakta hem de ölü/hasarlı sperm oranını daha da artırarak daha fazla toksik madde oluşumuna neden olmaktadır. Bu nedenle ayrıştırma tekniklerinin en etkili ayrıştırma tekniğinin en kısa sürede uygulanması son derece önemlidir.
Hazırlık işlemleri sayesinde aşağıdaki noktalar amaçlanmaktadır:
Semen antibiyotik içeren özel sıvılar ile yıkanarak zararlı mikroorganizmalar ortamdan uzaklaştırılır.
Semen içerisindeki seminal plazma, döküntü hücreler ve kontamine maddelerden arındırılır.
Daha iyi hareketliliğe ve şekle sahip spermlerin seçilmesi sağlanır.
Özellikle gradient yöntemi kullanılarak anormal şekildeki spermlerin ortamdan uzaklaştırılması ve daha iyi şekilsel yapıya sahip spermlerin seçimi sağlanır.
Böylece hazırlama sonrasında sperm yumurtayı dölleyebilme yeteneği kazanır.

Androloji laboratuvarı görüntüsü
Sperm Hazırlama Teknikleri:
İstanbul Memorial Hastanesi Androloji Laboratuvarı'nda sperm hazırlama yöntemi olarak şu teknikler kullanılmaktadır;
Sperm washing (yıkama)
Swim-up (yüzdürme)
Dansite Gradient
Mini Gradient
Bu yöntemler tek başına veya gerekli durumlarda birbirleri ile kombine edilerek bir arada kullanılmaktadır.
1. Sperm washing (yıkama): Bu yöntem sperm hazırlama tekniklerinin ilki olup birçok merkezde kullanılmaktadır. Bu teknik kültür medyumları ile semenin belli oranlarda karıştırılıp santrifüj edilmesi esasına dayanır. Bu metotla yüksek konsantrasyonda sperm elde edilmesine rağmen debris (hücre artığı) ve lökositler uzaklaştırılamamaktadır. Bu hazırlama tekniği merkezimizde sperm motilitesinin (hareketliliğinin) yeterli olduğu ve lökosit konsantrasyonun düşük olduğu durumlarda diğer tekniklerle kombine olarak kullanılmaktadır.
2. Swim-up (Yüzdürme) Tekniği: Swim-up yönteminin uygulanabilmesi için yeterli sayıda ileri hızlı harekete sahip spermin bulunması gerekir (sperm sayısı 4 milyon/ml üzeri ve hareketli sperm oranı %20’den fazla). Bu yöntem ile IUI, IVF ve ICSI için sperm hazırlanır. Özellikle normal viskoziteli (akışkanlıklı) ve yüksek hareketliliğe sahip semen örneği sperm sayısına bağlı olarak 2 – 4 santrifüj tüpüne konarak üzerine sperm yıkama medyumu eklenir 800 Rpm 10 dakika santrifüj edilir süpernatant uzaklaştırılır pellet üzerine 0,3 – 0,5 ml yıkama solüsyonu eklenerek 45o’lik eğimde 36oC’de %5 CO2 ortamda 45-60 dakika bekletilir. Bu sırada hareketli spermlerin üst yüzeye doğru ilerlemesi sağlanır. Ardından bu kısım alınarak işlemde kullanılır. Sperm parametrelerinin özelliğine göre bu aşama birkaç defa daha tekrarlanabilir.
|
|
|
|
Swim-up işleminde örnek yıkama solüsyonuyla santrifüj edildikten sonra üstte kalan süpernatant (düşük yoğunluklu üst faz) uzaklaştırılır pelletin üzerine taze yıkama solüsyonu eklenerek yüzey alanını artırmak amacıyla tüpler 45° lik açıyla inkübasyona bırakılır. |
|
Bu yöntem yüksek motiliteli spermlerin seçiminde etkili bir yöntemdir. Ancak, yine de seminal plazmadaki toksik maddelerin (ROS) ortamdan tam olarak uzaklaştırılmasını ve lökosit immatür hücre ve diğer hücresel artıkların tam olarak temizlenmesini sağlayamaz. Bu nedenle motil spermlerin fertilizasyon potansiyelini her zaman için garanti edemez.
3. Dansite Gradient Yöntemi: Genelde ICSI/IMSI işlemi için sperm hazırlamak amacı ile kullanılır. Merkezimizde bu amaçla, spermleri diğer maddelerden ayrıştıran özel solüsyonlar kullanılmaktadır. Semenin gradient oluşturan kolloidal silika partiküllerinden meydana gelen süspansiyon üzerine yerleştirilip santrifüj edilmesi ve böylece spermlerin sentrifugal kuvvetle silika partiküllerinin arasından tüpün dibine ilerlemesi esasına dayanmaktadır. Böylece daha iyi kalitede hareketli ve normal morfolojiye sahip spermlerin santrifüj tüpünün dibine doğru ilerleyerek burada toplanmasına ve işlem için daha iyi kalitede sperm elde edilmesi sağlanır. İmmatür hücrelerin ve lökositlerin de ortamdan uzaklaştırılmaları sayesinde bunlardan açığa çıkabilecek serbest oksijen radikallerinin azaldığı yapılan çalışmalar ile gösterilmiştir. Hazırlık sonucunda semen içerisinde bulunan immotil (hareketsiz) veya anormal spermler, lökositler ve diğer tüm hücresel fazlalıklar ayırılarak sadece hareketli ve sağlıklı spermlerin saptanabilmesine olanak sağlar. Ancak, yine de bu yöntem sperm sayısının çok az olduğu olgular (kriptozoospermi olguları) ve testis dokusundan sperm eldesi için uygun değildir.
Dansite gradient yöntemi ile özellikle düşük motiliteye sahip sperm
örneklerinde istenmeyen hücreler ayrıştırılır, santrüfüj işlemi sonrası alt
tabakaya geçen morfolojik olarak işleme uygun spermler seçilir.
4. Mini Gradient Tekniği: Bu yöntem daha çok testiküler sperm hazırlığında kullanılır. Bununla birlikte sperm sayısı çok düşük ve şekil bozukluğu yüksek seviyede olan semen örneğinden ICSI/IMSI için kullanılabilecek iyi kalitede sperm elde edilebilmesine de olanak sağlayan bir yöntemdir. Semen likefiye (sıvılaşmış) olduktan sonra 100 devirde 10 dk. swim up işlemine tabii tutulur. Ardından, konik tabanlı küçük tüplere 0.3 ml gradient tabakasından konularak aynı gradient yöntemindeki işlemler tekrarlanır.
|
|
|
|
Sperm sayısının çok az olduğu transient azoospermi vakalarında ya da testis spermi kullanılması gereken TESA ya da Mikro TESE işlemleri sonrasında yüzey alanını artırması amacıyla örnek bir çok tüpe paylaştırılarak ayrıştırılır sonrasında tüplerdeki örnekler konsantre edilerek maksimum sayıda sperm elde edilmesi amaçlanır. |
|
Sperm Seçim Teknikleri:
Erkek infertilitesi olan olgularda sperm değerlendirilmesi ve sperm hazırlığı sonrası YÜT’lerinde kullanılmak üzere uygun spermin seçimi son derece önemlidir. Teoride YÜT için tek bir sperm dahi yeterli ifadesi kullanılsa bile ideal olan normal morfolojiye sahip, genetik materyali hasarlı olmayan, hareketli ve canlı bir spermin seçilerek YÜT’lerinde kullanılmasıdır. Bu amaçla geliştirilen yöntemlerden biri yukarıda anlatılan MSOME tekniği ile sperm seçimi ve bu teknikle seçilmiş spermler ile yapılan mikroenjeksiyon uygulaması olarak tanımlanan IMSI tekniğidir. Ancak, bu yöntemle dahi gerek klinik gebelik oranlarında gerek canlı doğum oranlarında ve gerekse düşük oranlarında istenilen düzeyde iyileşme elde edilememiştir. Bu nedenle kaliteli sperm seçimine yönelik arayışlar halen daha devam etmekte ve farklı yöntemler tanımlanmaktadır. Bu yöntemlerin merkezimizde de uygulanan bazıları şunlardır.
Mikro Akışkan Kanal Sistemi ile Sperm Seçimi (Mikro Chip): Sperm hazırlama yöntemleri sırasında özellikle santrifüj esnasında sperm hasarı geliştiği ve buna bağlı olarak sperm DNA hasarının arttığı ileri sürülmektedir. Bu görüş dikkate alınarak sperm hazırlama tekniklerinde riskleri ortadan kaldırmak amacı ile spermatozoanın doğal ortamdaki seyrine benzer bir sistem içerisinde hareket etmesini sağlayan içi tamponize sıvı ile dolu kanalcıklar sistemi geliştirilmiştir. Mikro akışkan kanal sistemi (Mikro Chip=Sperm Chip) olarak adlandırılan bu sistemde bir noktadan konulan likefiye olmuş sperm örneğinin kanalcıklar içinde kendi hareketleri ile ilerleyerek diğer uca doğru ilerlemeleri beklenir. Burada bulunana havuzcukta biriken spermler toplanarak IUI/YÜT işlemlerinde kullanılır. Spermler kendi hareketleri ile kanalcık içinde hareket gösterdikleri için ilerleme gösteren spermlerin normal morfolojik yapıya sahip oldukları ve herhangi bir hazırlık işlemi tabii tutulmadıkları içinde hücresel hasara uğramadıklarından normal DNA yapısına sahip oldukları kabul edilmektedir. Yapılan çalışmalarda toplanan spermlerde hareket yüzdesi artmış, sperm DNA hasarı hazırlık yapılmış örneğe göre daha düşük bulunmakla birlikte henüz klinik sonuçlar istenilen düzeyde değildir. Henüz deneysel bir yöntem olarak kabul edilen mikro chip yöntemi şiddetli morfolojik bozukluğu olmayan, sperm motilitesi uygun olan erkek infertilitesi olan olgularda alternatif bir yöntem olarak uygulanabilir.
|
|
|
|
Mikro akışkan kanal sistemi ile sperm seçim yöntemi: a) Mikro Chip kanal lamı; b) Mikro akışkan sperm seçim tekniği. |
|
Sperm Yüzey Yüküne Göre Sperm Seçimi (Zeta (ζ)-Potansiyel ile Sperm Seçimi): Sperm hücre yüzeyinin taşıdığı elektronegatif yüke (-16 ile -20 mV) ve bu yükün büyüklüğüne göre sperm seçim işlemi gerçekleştirilir. Hızlı ve kolay uygulanan bir yöntemdir. Spermin sahip olduğu bu elektronegatif yüzey yükü spermin olgunluğunun bir göstergesidir. Ayrıca, negatif yük ile sperm hücresi diğer germ hücreleri ve lökosit artık hücresel yapılardan da ayrılabilmektedir. Yine bu yöntemde de santrifüj işlemi uygulanmadığı için sperm hasarı, hücresel artık ürünler (ROS) ve DNA hasarında artış izlenmemektedir.
Uygulama sırasında pozitif elektrik yüklü plastik santrifüj tüpü içine yıkanmış likefiye semen örneği konulur. Ardından lateks eldiven ile avuç içinde tüp 2-3 defa karıştırılır. Daha sonra 1-2 dk. santrifüj edilir. Tüp kenarına yapışmış spermler ve lökositler ortamdan uzaklaştırılırken, ortada yer alan hareketli spermler toplanarak kullanılır.
Bu yöntem az sayıda sperm elde edildiği için sperm sayısı düşük olan olgularda uygun değildir. ICSI ile olan üstünlüğü net olarak ortaya konulamamıştır. Sperm DNA hasarı olan ve sperm sayısı yeterli olan olgularda alternatif olarak kullanılabilir.
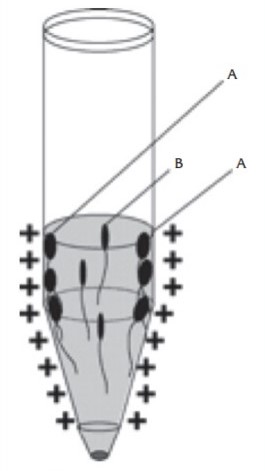
Zeta-potansiyel ile sperm seçimi:
A) Pozitif yüklü uygun olmayan spermler;
B) Negatif membran potansiyeli yüklü, hareketli YÜT için kullanıma hazır spermler
Sperm Membran Gelişimine Göre Sperm Seçimi: Oosit zarında doğal seçici olarak görev yapan hiyalüronik asit (HA) adı verilen bir protein bulunmaktadır. Sperm yüzeyinde ise bu proteine bağlanma gösteren bölgeler vardır. Bu yöntemde sperm ile oosit arasındaki bu etkileşimden faydalanılarak sperm seçimi yapılmaktadır. Burada iki farklı yöntemle sperm seçimi yapılmaktadır:
PICSI Dish: Üzerinde HA bulunan bölge olan özel olarak geliştirilmiş bir kaptır. Likefiye olmuş sperm örneği HA içeren bölgenin kenarına konulur ve 15 dk. sonra HA içinde bulunan spermler toplanır.

PICSI Dish ile sperm seçim yöntemi
Sperm Slow: Bu amaçla kullanılan bir başka yöntemdir. Burada likefiye sperm örneği HA içeren özel olarak geliştirilmiş bir medyum ile muamele edilir ve ardından spermler toplanarak YÜT’de kullanılır.
Yüksek hareket oranına sahip, daha canlı ve şekilsel olarak daha kaliteli spermler elde edilmekle birlikte, fazla oosit elde edilen olgularda uygun bir yönetme değildir. Sperm sayısı az ve hareket sorunu olan olgularda oosit sayısı da yeterli ise sperm seçimi olarak kullanılabilmektedir.
Sperm Membran Bütünlüğüne Göre Sperm Seçimi: Sperm zarının normal yapısı spermin canlılığının değerlendirilmesinde önemlidir. Bu amaçla kullanılan Eosin Y ve HOST testleri tanısal semen analizinde hareketsiz sperm izlenilen olgularda rutin olarak yapılmaktadır. Aynı zamanda, HOST testi nekrozoospermi ve total immotil sperm örneği olan olgularda hareketli sperm seçimi için de uygulanmaktadır. Aynı zamanda HOST testi sırasında izlenilen sperm morfolojisi ile DNA fragmantasyonu ve spermin kromozomal yapısı arasında yakın ilişki olduğu ortaya konulmuştur (b, c, d tiplerde anöploidi daha azdır).
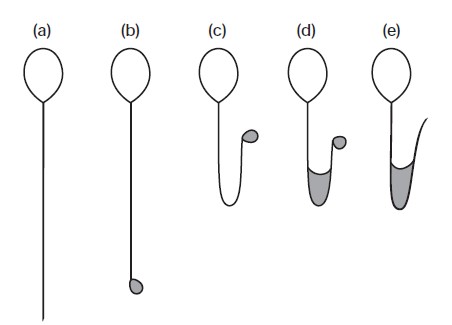
HOS Testi ile sperm seçimi:
a) Membran bütünlüğü bozulmuş, ölü sperm;
b-e) Membran yapısı sağlam hipo-osmolar sıvıyı içine alan ve kuyruk aktivasyonu gösteren spermler
Bu nedenle merkezimizde HOS testi ile sadece immotil sperm seçimi değil aynı zamanda, DNA hasarı olan olgularda, daha önce tekrarlayan gebelik kaybı olan olgularda ve erkek genetik faktörü olan olgularda da sperm seçimi yapılmakta; bu yöntem IMSI ile kombine edilerek YÜT uygulanmakta ve gerekli ve uygun olan olgulara PGT önerilmektedir.
Sperm DNA Hasarı nedir?
Erkek kısırlığı ile sperm hücresinin (spermatozoa) genetik yapısı arasındaki yakın ilişki vardır. Normal sperm testlerinde sperm sayısı, hareketlilik oranı ve şekilsel durumu değerlendirilir. Ancak tüm bu değerler gerek normal yolla gebelik için gerekse YÜT için yeterli olsa bile bazı durumlarda gebelik elde edilememekte veya başarısız sonuçlar ile karşılaşılmaktadır. Bu durumlarda özel değerlendirme yöntemleri ile sperm hücresinin DNA yapısının değerlendirilmesi gerekebilir. Sperm DNA yapısında bozukluk olması normal gebelik şansını önlediği gibi yardımcı üreme tekniklerinde döllenme şansını da düşürmekte, ayrıca oluşan embriyonun bir takım muhtemel risklere maruz kalmasına da neden olmaktadır.
Sperm hücresinin genetik materyali testiste yapım aşamasında protamin adı verilen özel proteinler tarafından yapısal değişime uğrar ve korunma altına alınır. Ayrıca, testis içinde spermlerin bulunduğu seminifer tubül adı verilen kanalcıkların kapalı bir ortamda olması da spermleri dış etkenlerden koruyucu bir mekanizmadır. Bu mekanizmaların gerek protamin yapısındaki hasar nedeni ile gerekse çevresel etkenler ve testis hasarı nedeni ile bozulması sonucu sperm genetik materyalinde hasara yol açmaktadır. Sperm hücresi hücresel yapısı özelliği ile çevresel etkenlere karşı son derece duyarlıdır. Enfeksiyonlar, çevresel toksik (İyonize radyasyon, kimyasal maddeler, ilaçlar, yüksek ısı vb.), testis torsiyonu, sperm kanalları tıkanması (cerrahi, travma, enfeksiyon vb.), hormonal faktörler (guatr), varikosel, obezite, sigara kullanımı ve yaş gibi pek çok sperm DNA hasarına yol açabilmektedir.
Sperm DNA hasarına yol açan en önemli neden bu etkenler sonucu ortaya çıkan seminal plazma içindeki toksik maddelerdeki artıştır. Reaktif Oksijen Ürünleri (ROS) olarak adlandırılan bu toksik maddeler sperm yapısını ve en önemlisi de DNA yapısını bozarak sperm fonksiyonunu etkilemektedir. Buna karşın seminal plazma içinde spermleri bu toksik maddelerden koruyan ve testisteki Sertoli hücreleri tarafından sentezlenen anti-oksidan adı verilen bazı maddeler bulunmaktadır. Bu antioksidan maddeler çeşitli enzimler (Katalaz), vitaminler (A, C, E vitaminleri) ve proteinlerden (albümin, transferin, seruloplazmin, laktoferin) oluşur. Normalde ROS ve anti-oksidan madde oranı dengede olması gereklidir. ROS miktarının anti-oksidan oranını aşması da sperm DNA hasarına neden olmaktadır.
Sperm DNA hasarı üç aşamada gerçekleşebilir:
Henüz sperm hücresi yapım ve gelişim aşamasında iken yani DNA paketlenmesi sırasında, DNA paketlenmesindeki mekanizmaların bozuk olmasına bağlı olarak hasar ortaya çıkabilir.
Sperm hücresi yapıldıktan sonra hasarlı hücrelerin vücuttan temizlenme mekanizmasında bozukluk neticesinde hasar ortaya çıkabilir.
Testiste yapılan spermin testisi terk ettikten sonra gelişen hatalar veya çevresel etkenler sonucu ejakülasyon (meninin cinsel ilişki ile dışarı atılması) işlemine kadar geçen bekleme süreci içinde hasar gelişebilir.
Yapılan çalışmalarda IVF uygulanan çiftlerde döllenme olasılığı DNA hasarı varsa %60’lardan %30’lara kadar azaldığı gösterilmiştir. Aynı şekilde mikroenjeksiyon (ICSI) uygulamalarında da tekrarlayan başarısız denemeler izlenebilmektedir.
Bu nedenle semen analizi parametreleri uygun olası bile sperm DNA hasarının saptanması ve tedavisine yönelik önlemler başarısız tüp bebek denemelerinde önem kazanmaktadır. Bu amaçla geliştirilmiş farklı testler bulunmaktadır. Bu testlerin hepsi normal yolla verilen sperm örneğinde uygulanmakta; ancak, farklı değerlendirme araçları kullanarak gerçekleştirilmektedir. Bu testleri kısaca şu şekilde özetleyebiliriz:
Sperm Kromatin Yapısı Tayini (SCSA); Özel bir boya olan akridin turuncusunun renk değiştirme özelliğinden faydalanılarak yapılır. Asit ortamda hasarlı sperm DNA’sının daha kolay boyanması özelliği kullanılır. Normalde turuncu boyanması gereken hücrelerde DNA hasarı varsa renk yeşil ve kırmızıya döner.
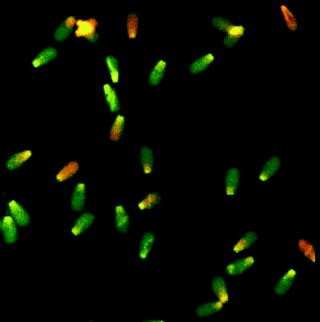
Sperm Kromatin Yapısı Tayini (SCSA) ile sperm DNA hasarı analizi.
Turuncu hücreler normal; yeşil hücreler hasarlı DNA yapısı göstermektedir.
Tek Hücre Jel Elektroforez (COMET); Hasarlı DNA’ya sahip sperm hücrelerinin elektrik alanındaki göçünü ölçer. Spermler özel bir ortama konularak elektriksel uyarı verilir. Sağlam DNA yapısı olan hücreler hareket etmez; hasarlı DNA yapısı olan spermler hareket eder. Bu esnada hareket eden hücrelerin arkasında kuyruklu yıldıza benzer bir görüntü oluşur. Kuyruğun yoğunluğu hasarın derecesini belirtir.

Tek Hücre Jel Elektroforez (COMET) ile sperm DNA hasarı değerlendirilmesi:
A) Normal; B, C ve D) DNA hasarlı sperm hücreleri.
TUNEL (Terminal Deoxynucleotidyl Transferase-mediated Deoxyuridine (TdT) Triphosphate (dUTP) Nick End Labeling Assay); Özel bir boyama yöntemi ile DNA kırıkları işaretlenir. Normal hücreler mavi renkte görülürken; hasarlı hücreler yeşil renkte, az hasarlı hücreler mavi/yeşil renkte görülür. Toplam hücre sayılarak yüzde olarak oran verilir. Değerlendirme özellikli immün floresan mikroskop veya flowsitometri ile yapılır.
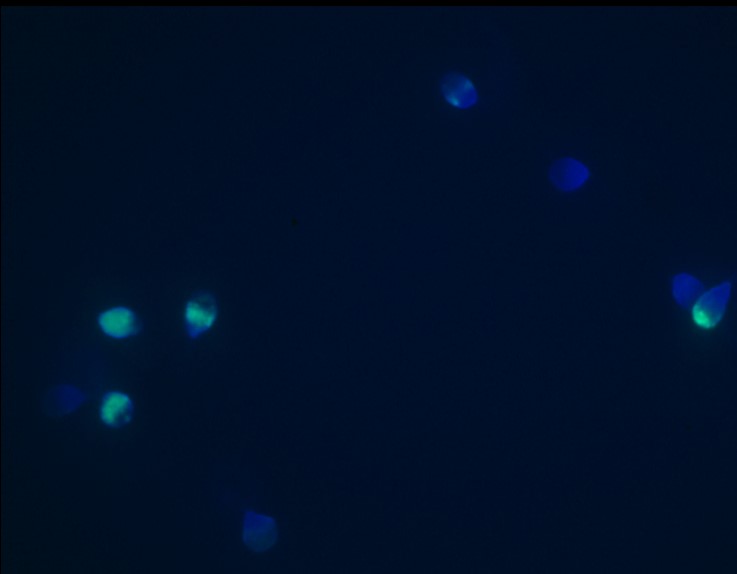
TUNEL ile sperm DNA hasar tayini. Mavi hücreler normal; mavi/ yeşil
hücreler az hasarlı, yeşil hücreler hasarlı DNA’ya sahip sperm hücreleri
Sperm Kromatin Ayrılma Testi (Halo Test=SCD); Parçalanmış DNA içeren spermlerin asit ile temas ettiğinde çevresinde karakteristik bir halo üretemediği prensibine dayanır. Asit içeren bir ortama konulan spermler bir seri işleme tabi tutulduktan sonra hücre etrafında bir halka oluşup oluşmadığına bakılır. Eğer bu yapı izlenmiyorsa sperm DNA’sı hasarlı olduğu kabul edilir.
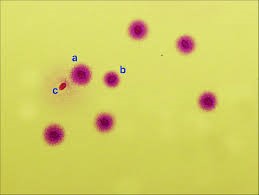
Sperm Kromatin Ayrılma Testi (Halo Test=SCD) ile sperm DNA hasarı
değerIendirmesi. a) Normal hücre; b) Hasarlı hücre.
Acridine Orange Test; Akridin turuncusu ile boyanan sperm hücreleri asit ortama yerleştirilir. Normalde yeşil boyanan hücrelerde hasar varsa renk kırmızıya döner. Hızlı, basit ve ucuz bir yöntemdir.
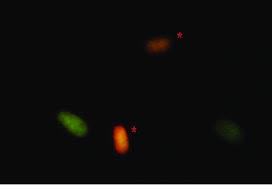
Acridine Orange ile sperm DNA hasarının değerlendirilmesi. Yeşil
normal sperm hücresi, turuncu hasarlı DNA hücresi.
Anilin Blue ile sperm boyanması; Anilin mavisi sperm kromatin bütünlüğünü değerlendirmek amacıyla kullanılan asidik bir boyadır. Hasarlı DNA’ya sahip spermler zayıf kromatin paketlenmesinden dolayı koyu mavi renkte boyanırken, normal spermler hücre yapıları sağlam olduğu için boyanmazlar.
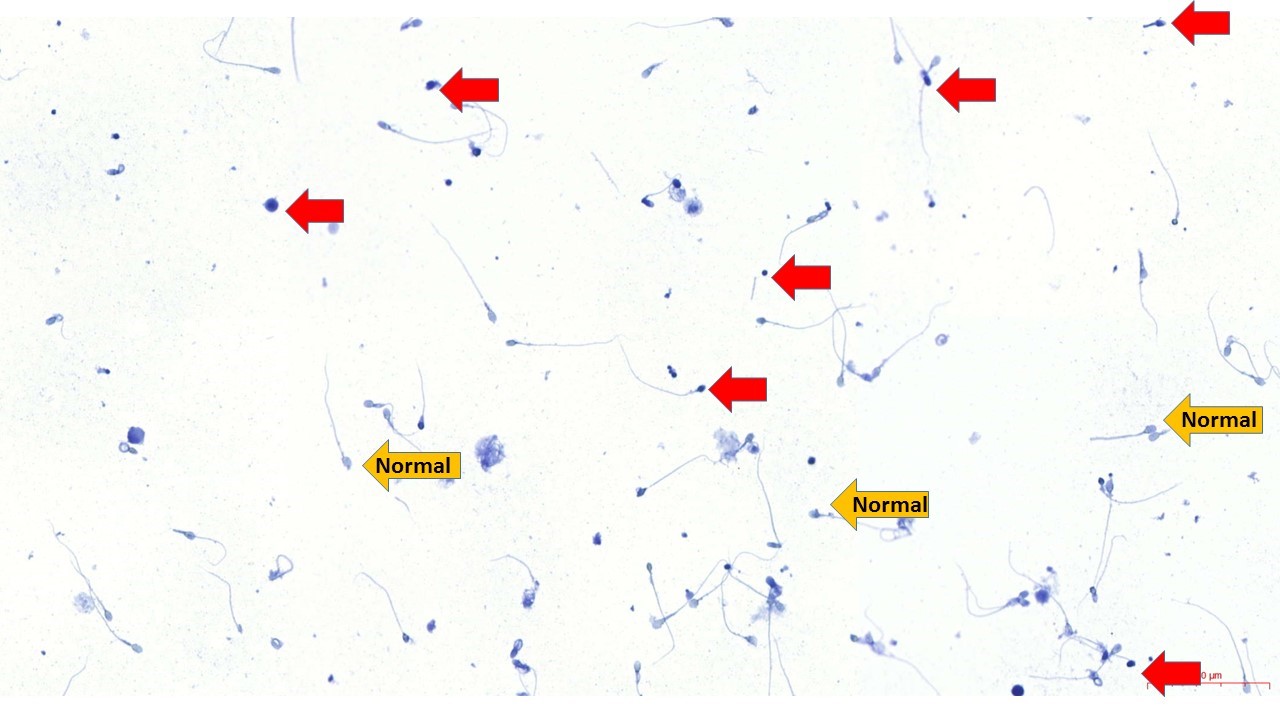
Kırmızı ok ile işaretli Anilin Blue ile koyu mavi boyanan hasarlı DNA’ya
sahip sperm hücreleri. Sarı ok ile işaretli, açık mavi renk boyanmış sperm
hücreleri normal DNA yapısına sahiptir.
Toluidine Blue ile sperm boyanması; Anilin Blue yöntemine benzer bir uygulamadır. Zayıf paketlenmiş veya hasarlı sperm DNA’sı kolay boyanır. Hasarlı spermler mavi boyanırken, hasarsız normal spermler renksiz izlenir.
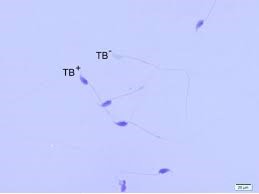
Toulidine Blue ile sperm DNA hasarının değerlendirmesi. TB (+)
boyanma gösteren DNA hasarlı sperm hücresi; TB (-) boyanma
izlenmeyen normal DNA yapısına sahip sperm hücresi
Laboratuvarımızda sperm DNA hasarının değerlendirilmesinde Anilin blue ve TUNEL test uygulanmaktadır.
Değerlendirme normal yolla alınan meni içindeki sperm hücrelerinde yapılır. Uygulanacak yönteme göre hazırlık yapıldıktan sonra değerlendirme yöntemi ile sperm hücresi sayımı yapılarak hasarlı sperm hücresi oranı hesaplanır. Değerlendirme sonrası normal, az hasarlı ve riskli grup olarak üç grupta değerlendirme yapılır:
DNA hasarı %15’ten az ise yeterli sağlıklı spermatozoa vardır ve fertilizasyon olasılığı yüksektir
DNA hasarı %15-30 arasında ise kabul edilebilir DNA hasarı vardır; buna rağmen fertilizasyon olasılığı vardır
DNA hasarı %30’dan fazla ise ileri derecede DNA hasarı vardır ve fertilizasyon şansı düşüktür
Sperm DNA hasarı yüksek olan olgularda nedene yönelik değerlendirme/Androlojik inceleme ve muayene yanı sıra laboratuvar yöntemi olarak ileri sperm seçim teknikleri veya yardımcı üreme tekniklerinde testiküler sperm kullanımı gibi yaklaşımlar uygulanmaktadır. Yapılan çalışmalar testis içinden elde edilen spermlerde DNA hasarının %4 iken, testisi henüz terk ederek epididimin ilk bölümü olan baş bölgesine gelmiş spermlerde %8’e; epididim orta bölgesine ulaşmış spermlerde ise %12’ye kadar ulaşabildiğini göstermektedir. Bu nedenle bu hastalarda TESA (Testiküler Sperm Aspirasyonu) adı verilen yöntemle lokal anestezi altında ince bir iğne ile girilerek testisten rahatlıkla sperm elde edilebilir ve yardımcı üreme yöntemlerinde kullanılabilir.
Kruger morfolojik değerlendirme sonrası belirli bazı şekil bozuklukları normal değerlerin çok üzerinde ise bu bozuklukların daha detaylı olarak incelenmesi önerilebilir. Özellikle genetik anomali ile birlikte olan bu olgularda spermin elektron mikroskobu ile yapısal özelliklerinin daha detaylı olarak ortaya konulduğu bu değerlendirme yöntemi sadece tanısal bir incelemedir. Aksi takdirde verilen tedavi kararını değiştirmede rol oynamaz.
Elektron mikroskobik değerlendirme şiddetli sperm şekilsel bozukluğu olarak kabul edilen aşağıdaki durumlarda önerilmektedir:
Globozoospermia (Akrozomsuz yuvarlak baş)
Megalohead (Büyük baş)
Pinhand (Nokta baş)
Tail-Stump
Segmental Mitochondrial Aplazia (Bölgesel Mitokondriyel Yokluk)
Extreme Dag Defect
Çoklu (multiple) baş ve kuyruk bozukluğu
Bu tetkik merkezimizde direkt olarak çalışılmamakla birlikte üniversite hastaneleri ile iş birliği içinde uygulanmaktadır. Hastanın işlemin yapıldığı merkezde vereceği semen örneği ile yapılmaktadır.
|
Tablo 3- Sperm DNA hasarını belirleyen testler |
||||
|
TEST |
AMAÇ |
YÖNTEM |
AVANTAJ |
DEZAVANTAJ |
|
TUNEL |
Tek ve çift DNA kırıkları |
Flowsitometri IFM IM |
Duyarlılığı yüksek Klinik önemli |
Özel ekipman gerekli Laboratuvarlar arası farklı değerlendirme |
|
COMET |
Tek ve çift DNA kırıkları |
Tek hücre elektroforezi IFM |
Duyarlılığı yüksek Kantitatif |
Zaman alıcı Sonuçlar standardize değil |
|
SCSA |
DNA denatürasyonu |
Flowsitometri |
Duyarlılığı yüksek Standart Klinik önemli |
Özel ekipman gerekli |
|
Akridine Orange Testi |
DNA denatürasyonu |
IFM Flowsitometri |
Kolay Ucuz |
Kişisel değerlendirme farklı Sonuçlar diğer testler ile uyumlu değil |
|
Anilin Blue Testi |
Lizin ve histon artıklarını boyama |
IM |
Kolay Ucuz |
Heterojen boyanma özelliği gösterir |
|
Touludine Blue Testi |
Fosfat artıklarını boyama |
IM |
Kolay Ucuz |
Heterojen boyanma özelliği gösterir |
|
|
|
|
|
Elektron mikroskobu ile |
Elektron mikroskobu ile görüntülenmiş enine sperm kuyruk kesiti |
|
Testislerden Sperm Elde Etme Yöntemleri
Menide sperm bulunamadığı durumlarda cerrahi yollarla testis içinden sperm elde edilebilir. Sperm bulmak için değişik yöntemler kullanılabilir. Testiste sperm üretiminin varlığı, uygulanan testlerle belirlenmişse, TESA tekniği, yani iğne ile testisten sperm aspirasyonu uygulanmaktadır. Testiste sperm üretiminin gerçekleşip gerçekleşmediği net olarak teşhis edilemediyse mikro cerrahi yöntemi ile Mikrodiseksiyon Testiküler Sperm Ekstraksiyonu (Mikro TESE) ile sperm elde edilebilir.
Mikrodiseksiyon Testiküler Sperm Ekstraksiyonu (Mikro TESE):
MikroTESE yöntemi mikrocerrahi gerektiren bir tekniktir. Cerrahın daha önce bu konuda deneyim sahibi olması işlemin başarısını artıracaktır.
Ameliyat mikroskobunun 20-30 kat büyütme avantajından yararlanılarak sperm üretiminin gerçekleştirildiği tübülus adı verilen testis içindeki ince kanalcıklar ameliyat mikroskobu altında büyütülerek ve büyük opak beyazımsı tübüller ayırt edilir. Bu görünümde olan tubüllerin daha fazla aktif germ hücre içerdiği ve olgun sperm bulunma olasılığının daha fazla olduğu kabul edilmektedir. Testis içinde mümkün olan en geniş ve opak görünmedeki tübüller ürolog tarafından alınır ve bir petri kabı içine konularak ameliyathanede bulunan embriyoloğa verilir. Bu tübüller embriyolog tarafından parçalanarak tübül içindeki germ hücreleri ve olası sperm dışarıya çıkması sağlanır. Ardından doku ilk olarak ameliyathane ortamında 200-400 büyütmeli ışık mikroskobunda değerlendirilir ve olgun (matür) sperm hücresi aranır. Eğer sperm hücresi izlenmiyorsa aynı işlem sperm hücresi bulunana veya ürolog tarafından testisin tüm tübüler yapıları yeteri kadar değerlendirilerek işlemin sonlandırılmasına karar verilinceye kadar devam edilir. Bir taraf testiste sperm izlenmediyse karşı taraf testise geçilir ve aynı işlem orada da devam eder. Eğer alınan tübül sperm içeriyorsa bu dokular sperm elde etmek amacıyla daha önce anlatıldığı gibi mini-gradient yöntemi ile hazırlanır. Hazırlanan spermler mikroenjeksiyon uygulanan mikroskopta ICSI uygulamak amacıyla toplanır.
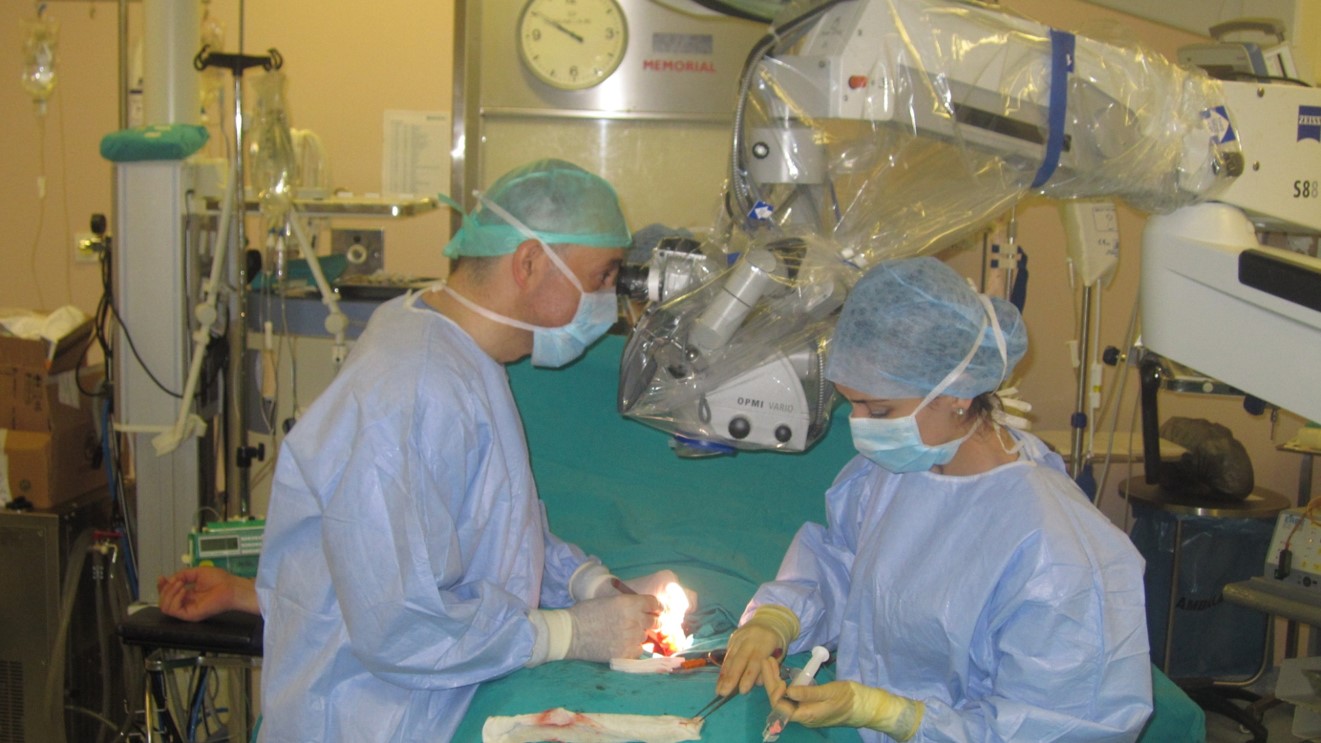
Mikro TESE işlemi
Klasik TESE biyopsi uygulaması
Mikro TESE işleminde ameliyat mikroskopunda izlenen genişlemiş
sperm kanalcıklarının (tübül) görüntüsü
|
|
MikroTESE işlemi |
Örneğin mikroskop |
Işık mikroskobunda x400 |
Mikro TESE işlemi ameliyat mikroskobu altında yapıldığı ve sadece genişlemiş kanalcıkların değerlendirilerek alındığı bir işlem olduğu için eski TESE biyopsi işlemine göre 70 kat daha az doku kaybına neden olmaktadır. Ayrıca, bu sayede daha az doku hasarı da ortaya çıkmaktadır. Kan damarlarının daha net olarak izlenmesi ve işlem sırasında korunması ameliyat sonrası dönemde ortaya çıkan doku bozukluklarını daha aza indirmektedir.
Yine tüm testisin ameliyat mikroskobu altında bir bütün olarak ve daha net olarak izlenmesi sperm elde etme şansını artırmaktadır. Klasik TESE-biyopsi ile %30-40 olan sperm elde oranı Mikro TESE ile %55-70 arasında değişmektedir.
Bu avantajları yanında testiste geniş bir kesi gerektirmesi ve tüm testisin boydan boya açılması, işlemin uzun süreli olması ve bu nedenle genel anestezi gerektirmesi Mikro TESE’nin dezavantajlarıdır. Bir kısım olguda ise ameliyattan sonra 6-8 hafta devam eden geçici bir hormonal bozukluk ve testosteron eksikliğine bağlı performans bozukluğu ve cinsel isteksizlik (libido kaybı) ortaya çıkabilmektedir. Bu durum hastanın ameliyat öncesi hormon düzeyi ile de yakından ilişkilidir. Bu nedenle hastaların ameliyat öncesi testosteron düzeylerinin mutlak suretle kontrolü önemlidir. Ayrıca, mikro cerrahi uygulama nedeni ile yüksek maliyeti ve işlemin cerrahi deneyim gerektirmesi de dezavantajları olarak kabul edilebilir.
Ameliyatın genel anestezi altında yapılması tercih edilen uygulama olmalıdır. Çünkü hem işlem süresinin uzunluğu dikkate alınarak lokal anestezinin uygulama sırasında sık sık tekrarlamasından kaçınılmakta, hem de eğer sperm bulunamaz ise bu durumun ameliyat esnasında hasta ve ameliyat ekibinden yaratacağı stres ve baskı ortadan kaldırılmaktadır. Hastanın ameliyat sonrası rahatlığı açısından da genel anestezi tercih edilen yöntemdir.
Hasta operasyon sonrası izlenip aynı gün taburcu edilir. Ayrıca ameliyattan 2. gün sonra yara pansumanı ve testisin durumunun değerlendirilmesi için hastaneye çağrılır. Hastaya operasyon sonrası antibiyotik ve antienflamatuar bir hafta tedavi uygulanır. Ayrıca, ameliyat sonrası ilk 24 saat testis üzerine skrotuma buz uygulaması önerilir. Dışarından gelen hastalar için, özellikle ilk 24 saat içinde seyahat etmemeleri istenmektedir.
Her cerrahi işlem gibi Mikro TESE’nin bazı komplikasyonları olabilir. Çok nadir ortaya çıkan bu komplikasyonlar kanama ve hematom oluşumu, yara yeri enfeksiyonu ve testis atrofisidir.
İlk Mikro TESE uygulamasında her zaman olasılık en yüksektir. Bu nedenle merkezimizde çiftlerin YÜT’lerine eş zamanlı olarak hazırlanmaları önerilmektedir. Mikro TESE öncesi testisten sperm elde edilebilme olasılığı gösteren hiçbir tanısal parametre yoktur. Daha önce anlatıldığı gibi sadece genetik olarak Y kromozom eksikliği olan bazı olgularda (Komplet AZF a, Komplet AZF b veya Komplet AZF a+b+c eksikliği olan olgular) sadece Mikro TESE önerilmemektedir. Bunun dışında her olgu önceden kemoterapi/radyoterapi almış dahi olsa dahi düşük sperm elde etme olasılığı ile Mikro TESE adayıdır. Bu nedenle azoospermi olan tüm olguların işlem öncesi detaylı değerlendirilmesi ve bilgilendirilmesi gereklidir. Mikro TESE işleminde bazen sperm testiste tek bir noktada (fokal odak) olabilir ve sadece burada alınan örnekte sperm saptanabilirken, testisin diğer yerlerinden alınan örneklerde sperm elde edilemeyebilir. Benzer şekilde daha önce yapılmış ve sperm elde edilmiş bir Mikro TESE sonrası tekrarlı Mikro TESE uygulamalarında %8-10 sperm elde edilememektedir. Bunun nedeni aynı şekilde tek odak olması ve bu odağın ilk uygulamada alınmış olmasıdır. Bu nedenle bir defa Mikro TESE ile sperm elde edilen bir olgunun daha sonraki uygulamalarda sperm elde edilemeyebileceği konusunda bilgi sahibi olması gereklidir.
Round Spermatid ve Elongated Spermatid Enjeksiyonu
(ROSI Tekniği):
Mikro TESE ile sperm elde etme oranı %50-70 arasında değiştiğini daha önce ifade etmiştik. Olguların %30-50’sinde sperm bulanmadığı ve YÜT’nin uygulamadığı çiftlerde arayışlar devam etmektedir. Bu çiftler için geçmişte de denemeleri yapılan öncü sperm hücreleri ile dölleme işlemleri denemeleri (ROSI tekniği) YÜT’lerindeki gelişmelere paralel olarak son yıllarda tekrar gündeme gelmiştir.
Testiste sperm kanalları içinde ana sperm hücresinden olgun sperm hücresine ulaşana kadar farklı gelişim aşamalarında öncül sperm hücreleri vardır. Bir ana hücreden olgun sperm hücresine ulaşana kadar geçen süre 64-72 gün arasında değişmektedir. Erken evre sperm hücreleri ilk aşamada 46 kromozom yapısı içerirken gelişimleri sürecinde genetik bölünmeye uğrar ve kromozom sayısını yarıya indirirler. Böylece bir kısmında 23, X ve bir kısmında ise 23, Y kromozom yapısı bulunur. Bu aşama tamamlandıktan sonra sperm kendi yapısal gelişimini tamamlama ve olgunlaşma aşamasına girer ve sperm kuyruğu oluşmaya başlar. Sperm kuyruğu oluşmadan hemen önceki aşamada, kromozom yapısının yarıya indiği evredeki hücreler yuvarlak sperm hücreleri (round spermatid); spermin kuyruk oluşumun başladığı hücreler ise elongated spermatid olarak adlandırılmaktadır (Şekil a ve b).
|
|
|
|
a) Round spermatid |
b) Elongated spermatid |
ROSİ ile ilk uygulamalar bundan 20 yıl öncesine kadar uzanmaktadır. Mikroenjeksiyon yöntemi ve testisten sperm elde etme yöntemlerinin tanımlandığı 1992 yılında hemen sonra ROSİ ile denemeler başlamıştır. Ancak, bu ilk uygulamalarda elde edilen sonuçlar başarılı olmamıştır. Bu dönemde yapılan 336 embriyo transferinde sadece 9 gebelik elde edilirken (%2,7), sadece 5 canlı doğum bildirilmiş ve 2 gebelik elde edilebilmiştir (%1,5). Son yıllarda yapılan uygulamalarda, ROSİ tekniği kullanılarak 4.090 yapılan embriyo transferlerinde 168 (%4,1) klinik gebelik elde edildiği bildirilmektedir.
Bu yöntemde en önemli nokta kullanılacak hücrenin gelişim aşamasındaki düzeyidir. Bu nedenle işlemden önce mutlaka tüm hastalardan sperm örneği alınarak örnekte özel bir mikroskop inceleme yöntemi olan inverted mikroskop ile elongated spermatid olup olmadığı değerlendirilir. Ardından standart Mikro TESE işlemi ile testisten alınan doku örneklerinde round ve elongated spermatid varlığı değerlendirilir. Bu aşama en önemli işlemlerden biri izlenen yuvarlak hücrelerin diğer sperm dışı hücrelerden ayrılabilmesidir. Bu amaçla, laboratuvarda dikkat edilmesi gerekli ve round/elongated spermatidleri diğer hücrelerden ayıran önemli kriterler şunlardır:
Diğer yuvarlak hücrelerden daha küçüktürler (6.5-8µm)
Normal spermatozoanın baş kısmında bulunan ve spermin oosit ile etkileşmesinde rol oynayan akrozom adı verilen bölge henüz oluşmamış ve hücre içinde parlak bir nokta şeklinde görülür
Hücrenin yüzeyi düzgündür
Round spermatid aşamasında kuyruk yoktur; elongated spermatid aşamasında ise kuyruk yapısı uzamaya başlamıştır
Round/elongated spermatid elde edilen olgularda mikroenjeksiyon işlemi uygulaması sırasında önemli bir aşama bu sperm hücrelerinde akrozom bölümü bulunmadığı için spermatidin oosit ile etkileşime geçmesinin mekanik yollarla gerçekleştirilmesini temin etmektedir. Bu amaçla kadından elde edilen oositler piezoeletrik adı verilen bir yöntem ile uyarılarak spermatid ile etkileşme geçmeye hazır hale getirilir. Ardından elde edilen round/elongated spermatid mikroenjeksiyon yöntemi ile oositin içerisine yerleştirilir.
ROSİ yöntemi halen daha deneysel bir uygulamadır ve bu uygulamanın bazı önemli sonuçları vardır:
1. Bu yöntemle daha önce de bahsedildiği üzere literatürde gebelik izlenmiş olmasına rağmen, gebelik oranı standart bir mikroenjeksiyon uygulamasından çok düşüktür (%4,1’e %80)
2. Elde edilen oositlerde döllenme görülebilmekte fakat öncü hücreler olan round spermatidlerin enjeksiyonu sonrasında embriyoların 3. güne veya 5. güne ulaşma oranları göreceli olarak düşüktür.
3. Embriyo transferi sonrası yüksek oranda düşük ile sonuçlanmaktadır (%60-70)
4. Literatürde 2 yıllık canlı doğum takibinde ROSİ bebeklerinde herhangi bir gelişimsel anomali izlenmediği belirtilmesine rağmen, bu uygulama sonrası yetişin yaşlarda ortaya çıkabilecek sorunlar henüz belli değildir
5. Yapısal olarak olgun olmayan sperm hücresi kullanıldığı için olası genetik sorunları ortaya koymak amacı ile transfer öncesi tüm olgularda PGT yapılmalıdır. Bu da zaten yüksek ücreti olan yardımcı üreme tekniklerindeki toplam maliyeti daha da artırmaktadır
Bu nedenle ROSİ tekniği ancak dikkatle karar verilerek uygulanması gereken bir teknik olarak değerlendirilmeli ve olası tüm sonuçlar çiftlere detaylı olarak açıklandıktan ve çiftler bilgi sahibi olduktan sonra gerçekleştirilmesi gereken bir uygulamadır.
TESA (Testiküler Sperm Aspirasyonu):
Lokal anestezi altında iğne ile pek çok noktadan girip testis dokusu aspire edilerek sperm arama işlemidir. Bu işlem esas olarak sperm kanallarında tıkanıklık nedeni ile spermin dışarı çıkamadığı durumlarda yapılır. Ayrıca daha önce menideki sperm ile yapılan tüp bebek uygulamalarında başarısız sonuçlar alınmışsa başarıyı arttırmak için menide sperm olmasına rağmen TESA uygulanabilir. Yine meninin mesane içine kaçtığı retrograd ejakülasyon/aspermi olgularında, tekrarlayan gebelik kayıplarında ve yüksek sperm DNA hasarı olan olgularda ve semen analizinde sperm hareket ve canlılığı düşük olan olgularda (total immotil sperm/nekrozoospermi) da TESA yöntem ile sperm eldesine başvurulabilir. Bu uygulamada testiste sperm üretiminin var olduğu bilindiği için sperm bulma şansı %100’e yakındır.
Alınan testis içeriği aynı Mikro TESE işleminde olduğu gibi önce mikroskop altında incelenir. Sperm varlığı gözlendikten sonra mini-gradient yöntemi ile hazırlanarak ICSI işlemi için kullanılır.
İşlem lokal anestezi altında yapıldığından hastanede kalış gerekli değildir. Hasta aynı gün günlük işlemlerine devam edebilir. Uygulama sonrası hafif ağrı olabilir. Bu nedenle ağrı kesici önerilir. Nadiren testiste kanama ve hematom olabilir. Bu nedenle işlem sonrası kısa süreli hastanede gözetim altında tutulurken (2 saat) testise buz uygulaması yapılır. Sonraki dönemde hastaya 5-7 gün slip tarzı iç çamaşırı giymesi önerilir.
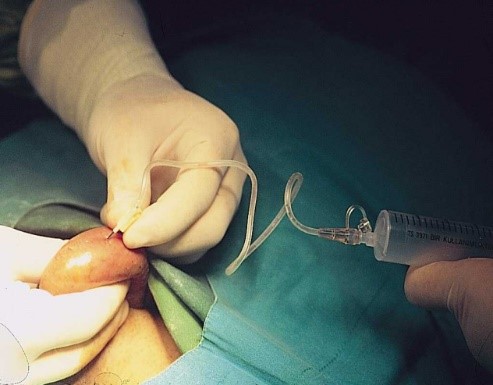
TESA ile sperm eldesi
Daha önceleri yukarıda sayılan durumlarda, özellikle tıkayıcı tipte azoospermi olgularında spermlerin testisten sonra depolandığı epididim kanalından aspirasyonla sperm eldesi işlemi (Perkütan Epididimal Sperm Aspirasyonu=PESA) veya ameliyat mikroskobu altında cerrahi yolla epididimden sperm aspirasyonu uygulaması (Mikro Epididimal Sperm Aspirasyonu=MESA) işlemleri yapılmaktaydı. Ancak, burada beklemiş spermlerde ortaya çıkan yüksek DNA hasarına bağlı başarısız YÜT nedeni ile artık her iki yöntemde tercih edilmemektedir. Bu iki yöntem yerine daha az DNA hasarı olan daha sağlıklı ve taze sperm eldesine olanak sağlayan TESA uygulanmaktadır.
Sperm hücreleri canlılıklarını uzun süre koruyabilmek amacı ile dondurularak saklanabilir ve istenildiğinde çözülerek yardımcı üreme tekniklerinde kullanılabilir. Dondurulmuş sperm ile ilk sağlıklı bebek 1973 yılında dünyaya gelmiştir. Dondurma işleminde, bu işlem için özel olarak üretilmiş kriyoprotektan adı verilen solüsyonlar kullanılır. Canlı hücrelerin dondurulması sırasında karşılaşılan en önemli problem hücre içerisindeki suyun donarak buz kristalleri oluşturması ve bu kristallerin hücre yapısına hasar vermesidir. Bunu engellemek için dondurma işlemi sırasında sperm içindeki su dış ortama çıkarılıp kriyoprotektanın hücre içine alınması sağlanır. Dondurulan spermler sıvı azot tankları içerisinde (-196 ̊C) saklanır. Dondurulmuş spermlerin çözülmesi sırasında kriyoprotektan hücre dışına çıkarılır ve hücre içine suyun geri alınması sağlanır. Dondurulan spermlerin çözülmesi sonrasında hareketlilik ve canlılık oranında düşüş gözlenmesi muhtemeldir. Bunun en önemli nedeni dondurulan örnekteki spermlerin tamamının bu işlemin stresine eşit ölçüde dayanıklı olmamasıdır. Ayrıca spermlerin bir kısmı işlem esnasında fiziksel hasara da uğramaktadır. Bugüne kadar yapılan bilimsel çalışmalarda, dondurulmuş çözülmüş hareketli spermler ile yapılan mikroenjeksiyon sonrasında döllenme ve gebelik oranlarının olumsuz etkilenmediğini göstermektedir. Şayet dondurma için iyi kalitede yeteri kadar sperm elde edilebilmişse dondurulup-çözünmüş spermler kullanılarak mikroenjeksiyon düşünülebilir. Elde edilen sperm sayısı dondurulup saklanmak için yetersiz ise işlem günü hastaya tekrar biyopsi işlemi uygulanabilir. Mikroenjeksiyon işleminde spermlerin canlılığı hareketli olup olmadıklarına bakılarak değerlendirilir. Hareketsiz spermler eğer hareketli spermler varsa tercih edilmez. Mikro TESE işlemi yapılması zorunlu olan azoospermik erkeklere Mikro TESE işlemi eşlerinden yumurtalarının toplanacağı gün yapılması önerilir. Bu vakalarda sperm elde etmek amacıyla uygulanan metotlar hastaya fizyolojik, psikolojik ve maddi bir yük getirdiğinden, mikroenjeksiyon işleminden sonra kalan spermler, yeterli bulunduğu takdirde olası diğer işlemlerde kullanılmak amacı ile dondurulmalıdır. Ancak testisten elde edilen spermlerin sayısı çok az ise çözüldüklerinde canlı sperm bulma olasılığı çok düşüktür. Bu nedenle bu hastalara bir sonraki denemede tekrar testiküler kaynaklı sperm elde etme yöntemleri uygulanır.

Sperm Dondurma
Testiküler/epididimal yoldan sperm elde edilen olgularda özellikle NOA olgularında yapılan Mikro TESE’de sperm bulunduğunda elde edilen spermin dondurularak daha sonraki uygulamalarda kullanılmak amacıyla dondurulması. Böylece işlem günü çözme sonrası elde edilecek sperm ile olgunun tekrar testis biyopsisine gitmesi engellenecektir.
Sperm Dondurma Nedenleri:
Şiddetli OAT olgularında ve sperm sayının progresif azalma gösterdiği veya vakalarda ardışık ejakülat örneklerinin dondurulup saklanmasıyla işlem günü YÜT için yeterli sperm elde edilmesi sağlanabilmektedir (sperm pooling). Bu uygulama için sperm kalitesinin (hareket ve canlılık) kabul edilebilir olması gereklidir.
Herhangi bir kanser nedeniyle kemoterapi ve/veya radyoterapi uygulanacak üreme çağındaki olgularda bu tedaviler ile sperm üretimi önemli ölçüde engelleneceğinden daha ilerideki YÜT için sperm elde etmek amacıyla tedavi öncesi sperm dondurma uygulanabilmektedir.
Testis ile ilgili çeşitli hastalıklar sonucu cerrahi tedavi görecek (orşiektomi yapılacak) veya vazektomi uygulanacak olgularda ileri tarihlerde sperm elde etmek amacıyla yapılabilmektedir.
İşlem günü psikolojik, sosyo-kültürel veya dini nedenlerle sperm vermede güçlük çekebilecek olgularda işlem öncesi sperm alınıp dondurularak YÜT’de kullanılabilmektedir.
Hipogonadotropik hipogonadizm olan olgularda başlangıçta azoospermik olsalar bile medikal tedavi ile sperm elde edilebilmektedir. Bu olgularda sperm üretimi sağlandıktan sonra ejakülat spermi ile YÜT uygulanabilir ve elde edilen sperm daha sonraki YÜT’de kullanılmak üzere dondurulabilir. BU olgularda medikal tedavi kesildikten sonra tekrar azoospermi gelişecektir.
HCV, HIV gibi viral hastalığı olan olgularda enfeksiyonun partnere ve fetüsa bulaşını engellemek amacıyla ejakülatta viral yük değerlendirilmesi yapılmak amacıyla semen örneği alınarak dondurulur. Dondurulan örneklerden bir bölümü viral yük değerlendirilmesi için PCR çalışılır. Viral yük negatif ise bu örnekler YÜT için kullanılabilir.